EC je elektrická vodivost, tedy schopnost jakéhokoli materiálu vést elektrický proud. Zatímco většina pěstitelů je zvyklá měřit množství výživy, kterou poskytují, v gramech na litr nebo v jiných měrných jednotkách, EC jde o něco dále. Je důležité, aby zahradníci dobře rozuměli tomu, co je EC/PPM a proč na tom záleží.
Elektrická vodivost vody
EC měřič měří potenciál elektrického proudu procházejícího vodou. Toto je známé jako molární vodivost (elektrolytická vodivost) a měří se v siemens (S) nebo přesněji milisiemens (mS/cm). Elektrony jsou schopny procházet vodou z jedné elektrody na druhou díky iontům rozpuštěným ve vodě. Právě tyto ionty nesou elektrony.
Stejně tak koncentrace iontů ve vodě určuje počet elektronů, které se mohou pohybovat od jedné elektrody ke druhé: čím vyšší je koncentrace iontů, tím větší je tok elektronů. Čistá voda je velmi špatným vodičem elektřiny, takže dešťová voda, voda z reverzní osmózy nebo demineralizovaná voda budou na EC měřiči ukazovat 0,0. Slaná mořská voda je naopak mnohem lepší vodič.
Když přidáme do vody živiny (sůl), zvyšujeme molární potenciál vedení proudu vodou a tím zvyšujeme hodnotu EC (neboli CF = EC*10). Všechna měření vodivosti jsou přímo ovlivňována teplotou a musí být zohledněna při jejich provádění.
Jednotky EC
Elektrickou vodivost lze vyjádřit pomocí několika různých jednotek:
EC — siemens na metr2 na mol (S/m2/mol) nebo milisiemens na centimetr (mS/cm). Jednotka mS/cm se v Evropě běžně používá jako referenční pro stanovení koncentrace živin ve vodě.
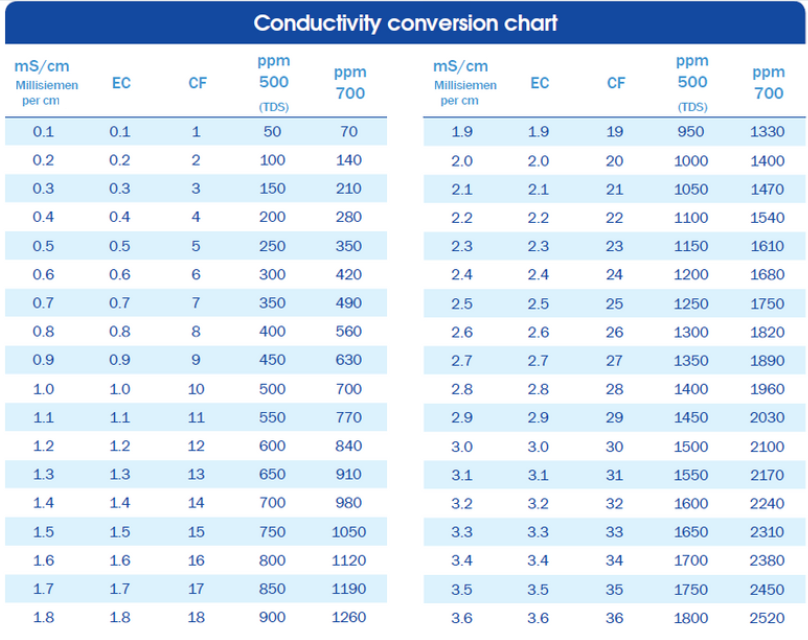
TDS (PPM) – V Severní Americe se vodivost převádí na počet iontů ve vodě pomocí Parts Per Million, které lze také převést na jednotky včetně mg/l atd. To se provádí převodem EC na hodnotu založenou na iontech obsažených v roztoku. Naštěstí existuje pevný výpočet poměru mezi všemi těmito jednotkami, který je uveden v tabulce níže.
Je hodnota EC nutriční?
Voda obsahující minerální soli má EC, ale samotná přítomnost EC nemusí nutně znamenat, že voda obsahuje výživné soli, které rostlinám pomohou. Voda z vodovodu může obsahovat například sodík a chlorid, které mají hodnotu EC, ale nemají žádnou nutriční hodnotu pro rostliny.
Hnojiva se samozřejmě skládají z výživných solí. Jakákoli nutriční hodnota, kterou do vody přidáme, je známá jako EC a musí být přidána ke zbytkovému EC vody. Takto měříme celkové EC v našem živném roztoku.
Jedlé soli jsou pevné látky, které byly extrahovány ze země nebo uvolněny průmyslovým procesem krakování. Určité množství solí (v gramech) rozpustíme v určitém objemu vody (v litrech), což znamená, že pro měrnou jednotku EU můžeme použít i gramy nebo litry. I když má každé hnojivo svou hnojivou hodnotu, můžeme zobecnit a říci, že roztok s EC 1,0 mS/cm bude obsahovat až 1,0 gramu měřitelných solí na 1 litr vody.
Vysoká úroveň EC
Sůl má schopnost přitahovat vodu k sobě, proces známý jako hydrolýza. Například nádoba se solí umístěná ve sklepě sníží atmosférickou vlhkost přitahováním vody z atmosféry. V roztoku bude mít koncentrace solí vždy tendenci se vyrovnávat mezi dvěma oblastmi různé koncentrace – jinými slovy, voda se přesune do oblasti s vyšší koncentrací. Tento rozdíl v koncentraci je známý jako gradient vodního potenciálu a také hraje roli v naší kultivaci prostřednictvím procesu známého jako osmóza.
Osmóza zahrnuje přítomnost semipermeabilní bariéry, která umožňuje molekulám vody procházet, ale omezuje pohyb iontů nebo solí v roztoku. Když ve vodě rozpustíme hodně živin (vytvoříme vysoké EC/PPM), živné soli přitahují vodu v substrátu. To ztěžuje kořenům extrahování vody ze substrátu. Můžeme tedy vytvořit podmínky, ve kterých kořeny již nejsou schopny ze substrátu čerpat vodu, i když je substrát nasycený. To se nazývá „fyziologická suchost“ substrátu. Výsledkem je, že rostliny již nemají vodu k chlazení pocení (odpařování), které potřebují v přítomnosti tepla a světla.

I když se tento účinek běžně nazývá „předávkování hnojivy“, ve skutečnosti je to důsledek nedostatku vody v rostlině se všemi škodlivými důsledky, které s tím souvisí. Při použití řezaných květin, jako jsou růže nebo rostlinné řízky, může vyšší EC ve váze nebo řezací zátce doslova vytáhnout vodu ze stonků.
Sůl má schopnost přitahovat molekuly vody. Když přidáte sůl do vody na pravé straně zkumavky (tím zvýšíte hodnotu EC), molekuly soli přitáhnou molekuly vody na levé straně, která má méně soli. Hladina vody v pravé polovině stoupá, dokud se hodnoty EC (koncentrace soli) v obou polovinách nevyrovnají.
Tento osmotický proces můžeme vidět v akci v trubici ve tvaru U, pokud obě strany oddělíme propustnou membránou (například kouskem stonku). Pokud nyní přidáme trochu soli na jednu stranu zkumavky, hladina vody na této straně stoupne, protože k ní bude přitahována voda s nižší EC (nižší koncentrace soli). To vše znamená, že je důležité přidávat malé nebo žádné živiny na začátku procesu růstu.
Interní EC
Poté, co rostlina přijme živiny ze živného roztoku, je nutné pokusit se co nejrychleji zvýšit osmotickou hodnotu (resp. vnitřní koncentraci soli) rostliny. Jak se zvětšuje objem rostliny, jak roste a přijímá vodu, osmotická hodnota klesá. Soli uvnitř rostliny se redistribuují a rostlina se stává měkčí a má světlejší barvu. Díky tomu je rostlina velmi náchylná k dehydrataci (vadnutí), protože voda může rostlinu snadno opustit.
Pokud dáte kořenům více výživy, úměrně to ovlivní růst. Protože se voda používaná k transportu živných solí odpařila, zůstávají soli v rostlině a zvyšují její vnitřní EC (osmotická hodnota). To znamená, že pěstitel může kořeny opět vystavit roztoku s vyšším EC, tedy doplnit výživu.
Zvýšení úrovně EC
Dosažením této pozitivní spirály akumulace EC v rostlině se rostlina také stává schopnější absorbovat a zadržovat vodu. To znamená, že se voda z rostliny neodpařuje příliš snadno a nedochází k jejímu příliš rychlému odvodnění.
Když rostliny příliš změknou, je nutné snížit intenzitu osvětlení nebo snižte počet hodin světla, abyste zabránili jejich vysychání na konci dne. Přestože ES hraje v tomto příběhu důležitou roli, není jediným faktorem, který má vliv. Celkové klima kolem závodu ovlivňuje procesy, kterých je EC součástí.
Nutriční potřeby
Při tvorbě vnitřního EC rostliny a následně substrátu EC je důležité vzít v úvahu růstové potřeby rostliny. Tyto potřeby jsou řízeny asimilací. Čím více rostlina roste, tím více výživy vyžaduje. Tyto živiny jsou částečně zadrženy v rostlině a přeměněny na aminokyseliny, oleje, tuky atd., ale některé soli živin zůstávají také v rostlinné míze a ty určují vnitřní EC rostliny. Draslík je pro to jednou z nejdůležitějších živin.
Po ukončení vegetativní růstové fáze může rostlina stále absorbovat hodně draslíku pro vnitřní osmotickou hodnotu a vaječníky. Vaječník je neoplodněné „semeno“. Tato rostoucí míra absorpce se však chýlí ke konci. Zhruba po 60 % růstového cyklu bude rostlina přijímat dostatek živin ze zásob v substrátu. Nyní začíná pro pěstitele hra mezi přísunem živin a aplikovaným EC.
Elektrická vodivost v hydroponii
K pochopení tohoto principu můžeme použít princip kbelíku.
Zatímco se voda v substrátu odpařuje, soli se nevypařují. proto byste měli v posledních týdnech růstu rostlin ve většině případů přestat krmit a přidat pouze vodu . Protože pokud je v substrátu málo vody, může se hodnota EC (koncentrace soli) prudce zvýšit.
Příklad:
Máme kbelík obsahující 10 litrů roztoku hnojiva s EC 2 mS/cm.
To znamená, že kbelík obsahuje 20 gramů výživných solí. (2,0 g/l x 10 litrů). Pokud se odpaří 9 litrů vody, zbude vám 1 litr vody s EC 20 (EC = 20 gramů soli v 1 litru vody). Ve skutečnosti k takovému extrémnímu příkladu nedojde a při pěstování v půdě dále proces vyrovnávací paměti , který do jisté míry váže soli živin na částice organického substrátu, ale princip zůstává pravdivý. Přidáním 9 litrů vody se EC vrátí na 2 mS/cm. Pokud tedy potřebujeme udržet EC mezi 2 a 4 mS/cm, musíme po odebrání 5 litrů vodu doplnit (4 g/l x 5 litrů = 20 g, EC = 4 mS/cm).
Pokud je v kbelíku rostlina a ta absorbovala 5 gramů solí z roztoku, můžeme ji doplnit za přidávání vody, abychom udrželi 2,0 EC. Pokud potřebujeme přidat např. 5 litrů vody, musíme přidat 5 gramů solí, nebo zkrátka dávku 5 litrů vody s EC 1,0 (g/l) nebo mS/cm. Cílem zde a při pěstování rostlin je udržovat konstantní EC v kbelíku.
To je základ pro hnojení. Snažíme se v nádobě udržovat určitou plodnost, která rostlině poskytuje dostatečné množství živin. Celkově bychom měli EC v závěrečném období snížit. V odvodněném systému můžeme sami snížit přísun živin, opláchněte jej roztokem s nižším EC. Podklad v odvodňovaných systémech lze mnohem snadněji upravit. V neodvodněných systémech lze přísun živin pouze zvýšit a je neustále doplňován postupnými aplikacemi krmiva. Dříve nebo později se tento přísun živin dostane na úroveň, která zpomalí a následně zastaví schopnost rostliny absorbovat vodu a následně skutečně vytlačí vodu z rostlinné tkáně, čímž se celý proces obrátí.
Shrnutí
Kromě toho, že je EC jednotkou měření množství hnojiva aplikovaného na rostliny, je také mechanismus klimatizace spojené s absorpcí vody.
Rostliny by měly být zahájeny s nízkým EC a poté pěstovány tak rychle, jak je to možné, aby byly splněny nutriční potřeby rostliny a také by se měla zvýšit vnitřní osmotická hodnota pro vytvoření silnější rostliny.
V posledních týdnech pěstování rostlina prakticky nepotřebuje krmení. Nadále krmíme pouze proto, abychom udrželi zásobu živin v květináči a udrželi stabilní EC. To má obvykle za následek pokles EC nebo dokonce týdenní vymývání (vyplavování).

Hodnota pH je hodnota pH, která umožňuje určit, kolik volných vodíkových iontů je obsaženo ve vodném roztoku. Při rozpuštění různých solí ve vodě nebo např. při přípravě určitého roztoku dochází k narušení acidobazické rovnováhy, po které je nutné změřit pH.
Zároveň bychom si neměli zaměňovat parametry, které určují zásaditost a kyselost roztoku s indikátorem pH, protože mezi nimi existuje určitý rozdíl, ale mnozí si tento rozdíl stále nevšimnou. Hodnota pH ve skutečnosti určuje úroveň zásaditosti a kyselosti roztoku, ale kyselost a zásaditost roztoku již vypovídá o množství sloučenin obsažených v roztoku a pomáhajících neutralizovat zásadu nebo kyselinu.
Rychlost chemických reakcí přímo závisí na úrovni pH.
V hydroponických aplikacích je velmi důležitá kontrola pH. Vliv pH na vývoj rostlin má pozitivní i negativní účinky. Protože jeho nekontrolovaná změna v jakémkoli směru může vést k mnoha problémům a dokonce ke smrti rostliny, což se často stává.
V běžném životě se koncentrace pH musí udržovat v mezích, aby neovlivňovala kvalitu vody. Pitná voda se tedy vyznačuje úrovní pH 6-9, zatímco u roztoků používaných v hydroponii se obvykle pohybuje v rozmezí 5.5 až 7.5.
Je potřeba systematické stanovení pH?
pH vodných roztoků hraje hlavní roli při určování výkonu a vlastností hydroponického roztoku. Koneckonců, při optimální úrovni pH rostliny snadno přijímají živiny, které jsou tak nezbytné pro úspěšný vývoj a růst.
Stojí za zmínku, že se sníženým pH kyselosti získává roztok nepříjemnou vlastnost – korozivní aktivitu. Když se úroveň pH zvýší pH>11, roztok má nepříjemný zápach. Je třeba s ním zacházet zvlášť opatrně, protože může dráždit pokožku a oči člověka.
Mělo by být také objasněno, že neexistují žádné ideální a konstantní hodnoty pH. Pro určité druhy rostlin by to mělo být asi 6.8 – 7.5 a pro jiné plodiny – asi 5.5 – 6.8.
metody kontroly pH
Existuje několik poměrně běžných způsobů, jak kontrolovat pH faktor: měření pH pomocí univerzálních indikátorů: pH metr, pH proužky, test pH kapaliny.
Podle některých odborníků vypadá taková metoda měření, jako jsou pH testovací proužky, trochu drsně. Spočívá v použití univerzálních indikátorů, které jsou směsí několika proužků za použití barviv, jejichž barva závisí přímo na acidobazickém prostředí: od červené, lehce dojemné žluté, dále zelené, modré a nakonec do fialové. K tomuto druhu zbarvení dochází v důsledku přechodu z kyselé oblasti do alkalické oblasti. Bez ohledu na to, jak univerzální je tato metoda regulace, má jednu podstatnou nevýhodu: pH prostředí se výrazně mění, pokud má roztok například nějakou barvu nebo je zakalený.

Pokud jste jako metodu monitorování pH vodných roztoků nebo pH půdy zvolili pH metr (například elektronický pH metr KL-009(III) (s teplotním senzorem) nebo elektronický pH metr KL -009(I)A), v tomto V tomto případě můžete měřit hladinu pH v rozsahu od 0,01 do 14. Díky tomu získáte přesnější informace než při použití indikátorů.
Funkce takového pH přístroje je založena na měření EMF galvanického obvodu, který má ve svém provedení skleněnou elektrodu, jejíž potenciál přímo závisí na koncentrovaném obsahu iontů H+ v konkrétním roztoku. Tato metoda je velmi pohodlná, protože přesnost zařízení přímo závisí na včasné kalibraci. Pomocí této metody je docela snadné určit pH roztoku, když se zakalí nebo zbarví. Vlastně díky tomu je tato metoda jednou z nejoblíbenějších.
Odborníci také často doporučují jednoduchý a levný, ale velmi spolehlivý test pH kapaliny. Tato metoda často úspěšně nahrazuje drahé elektronické pH metry.
úprava pH
Pro snížení nebo zvýšení kyselosti hydroponického roztoku použijte speciální roztoky pro snížení nebo zvýšení pH. Pozor, k výměně roztoku stačí pár kapek na litr.

Použití pH Down a pH Up:
Pro posun pH nahoru nebo dolů se používají speciální roztoky pH UP a pH Down.
Při rychlosti 3 ml na 10 litrů pro posun o 1 bod nahoru nebo dolů.
Například vaše pH vody je 4,0 a musíte ho zvýšit na 5,5. Provádí se následující výpočet:
5,5-4,0=1,5×3=4,5 ml pH UP na 10 litrů vody.
Výpočet je podobný pro pH DOWN
Co je tds?
TDS, ppM nebo pH solí – celkový obsah solí v roztoku
Stojí za to se dotknout tématu mineralizace. Proces, jako je mineralizace, je stanovení celkového množství solí obsažených v roztoku. Mezi nejběžnější je třeba poznamenat anorganické soli. Mohou to být chloridy, hydrogenuhličitany, sírany draslíku, vápníku, sodíku, hořčíku, může to být i minimální počet organických sloučenin, které se rozpouštějí ve vodě.
V každodenním chápání je to úroveň tvrdosti a měkkosti vody.
Měření TDS
Pro měření hladiny soli je nejjednodušším způsobem zakoupení měřiče soli digitální TDS metr. Toto zařízení určí ppm roztoku během několika sekund.
TDS
V Evropě se mineralizace obvykle nazývá dvěma způsoby: a Total Dissolved Solids (TDS). To bude přeloženo do ruštiny jako počet rozpuštěných částic. Jednotkou pro stanovení úrovně mineralizace je 1 mg/litr. Jedná se o ekvivalentní parametr pro hmotnost všech rozpuštěných částic a prvků v miligramech, konkrétně solí, které jsou obsaženy v litru roztoku.
ppm
Úroveň exprese mineralizace může být také zobrazena v ppM. Tato zkratka znamená části na milion, což v překladu do ruštiny znamená „parts per million“, tedy kolik částic soli je rozpuštěno v 1 milionu částic vodného roztoku. Podobnou zkratku lze nalézt v některých evropských zdrojích. Vypadá to takto: 1 mg/l = 1 ppm.














