Oxidačně-redukční potenciál je zvláštní, úzký případ pojmu elektrodový potenciál. Pojďme se na tyto pojmy podívat blíže. V OVR přenos elektronů redukční činidla oxidační činidla dochází při přímém kontaktu částic a energie chemické reakce se přeměňuje na teplo. Jakákoli energie OVR, vyskytující se v roztoku elektrolytu, lze přeměnit na elektrickou energii, pokud jsou například redoxní procesy prostorově odděleny, tzn. K přenosu elektronů redukčním činidlem dojde přes elektrický vodič. To je realizováno ve voltaických článcích, kde se elektrická energie získává z chemické energie redoxní reakce.
Element Daniel-Jacobi
Zvážit Galvanický článek Daniel-Jacobi, ve kterém je levá nádoba naplněna roztokem síranu zinečnatého ZnSO4, se zinkovou deskou spuštěnou do ní a pravou nádobou – roztok síranu měďnatého CuSO4, s měděnou deskou spuštěnou do ní.

Interakce mezi roztokem a destičkou, která funguje jako elektroda, pomáhá elektrodě získat elektrický náboj. Nazývá se potenciálový rozdíl vznikající na hranici roztoku kov-elektrolyt elektrodový potenciál. Hodnota a znaménko (+ nebo -) potenciálu elektrody jsou určeny povahou roztoku a kovu v něm. Při ponoření kovů do roztoků jejich solí více aktivní z nich (Zn, Fe atd.) jsou záporně nabité a méně aktivní (Cu, Ag, Au atd.) pozitivní. Výsledkem spojení zinkové a měděné desky s elektrickým vodičem je výskyt elektrického proudu v obvodu v důsledku toku elektronů ze zinku na měděnou desku vodičem. V tomto případě se počet elektronů v zinku snižuje, což je kompenzováno přechodem Zn 2+ do roztoku tzn. zinková elektroda se rozpouští – anoda (oxidační proces). Zn-2e- = Zn2+ Nárůst počtu elektronů v mědi je zase kompenzován výbojem iontů mědi obsažených v roztoku, což vede k akumulaci mědi na měděné elektrodě – katoda (proces obnovy): Cu 2+ + 2e – = Cu V elementu Daniel-Jacobi tedy dochází k následující reakci: Zn + Cu 2+ = Zn 2+ + Cu Zn + CuSO4 = ZnSO4 + Cu Vyčíslit redoxní procesy umožňují elektrodové potenciály, měřeno relativně k normálu vodíková elektroda (předpokládá se, že jeho potenciál je nulový). K určení standardní elektrodové potenciály použít článek, jehož jedna z elektrod je testovaný kov (nebo nekov) a druhá je vodíková elektroda. Na základě zjištěného rozdílu potenciálu na pólech prvku se určí normální potenciál studovaného kovu.
Redoxní potenciál
V případě potřeby se použijí hodnoty oxidačně-redukčního potenciálu určení směru reakce ve vodných nebo jiných roztocích. Proveďme reakci 2Fe 3+ + 2I — = 2Fe 2+ + I2 takže jodidové ionty a železité ionty vyměnili své elektrony přes vodič. V nádobách obsahujících roztoky Fe 3+ a I – umístěte inertní (platina nebo uhlík) elektrody a uzavřete vnitřní a vnější okruh. V obvodu vzniká elektrický proud. Jodidové ionty odevzdávají své elektrony, které protečou vodičem k inertní elektrodě ponořené do roztoku Fe 3+ soli: 2I — — 2e — = I2 2Fe 3+ + 2e – = 2Fe 2+ Na povrchu inertních elektrod probíhají oxidačně-redukční procesy. Potenciál, který vzniká na rozhraní mezi inertní elektrodou a roztokem a obsahuje jak oxidovanou, tak redukovanou formu látky, se nazývá rovnováha redox potenciál.
Faktory ovlivňující hodnotu redox potenciálu
Hodnota redox potenciálu závisí na mnoha faktory, včetně například: 1) Povaha látky (oxidační a redukční činidlo) 2) Koncentrace oxidovaných a redukovaných forem. Při teplotě 25°C a tlaku 1 atm. hodnota redox potenciálu se vypočítá pomocí Nernstovy rovnice: E = E° + (RT/nF)ln(Cca/Cslunce), kde E je redoxní potenciál daného páru; E° – standardní potenciál (měřeno při Cca = Cslunce); R – plynová konstanta (R = 8,314 J); T – absolutní teplota, K n – počet elektronů odevzdaných nebo přijatých v redoxním procesu; F – Faradayova konstanta (F = 96484,56 C/mol); Cca – koncentrace (aktivita) oxidované formy; Cslunce– koncentrace (aktivita) redukované formy. Dosazením známých dat do rovnice a přechodem na desetinný logaritmus získáme následující tvar rovnice: E = E° + (0,059 /n)lg(Cca/Cslunce) na Cca > Cslunce, E > E° a naopak pokud Cca 2-, CrO4 2-, MnO4 — ) s klesajícím pH roztoku roste redoxní potenciál, tzn. potenciál se zvyšuje s rostoucím H+. Naopak redoxní potenciál klesá s poklesem H +. 4) teplota S rostoucí teplotou se zvyšuje i redoxní potenciál tohoto páru. Standardní redoxní potenciály jsou uvedeny v tabulkách ve speciálních referenčních knihách. Je třeba mít na paměti, že jsou uvažovány pouze reakce ve vodných roztocích při teplotě ≈ 25°C. Takové tabulky to umožňují nějaké závěry:
Co lze určit hodnotou oxidačně-redukčního potenciálu
- Velikost a znaménko standardních redoxních potenciálůnám umožňují předpovědět, jaké vlastnosti (oxidační nebo redukční) atomy, ionty nebo molekuly budou vykazovat v chemických reakcích, např.
E°(F2/2F – ) = +2,87 V – nejsilnější oxidační činidlo
E°(K + /K) = – 2,924 V – nejsilnější redukční činidlo
Redoxní pár bude mít větší redukční výkon, tím větší je jeho číselná hodnota negativní potenciála jejich oxidační kapacita nadNež pozitivnější potenciál.
- Je možné určit, která ze sloučenin jednoho prvku bude mít nejsilnější oxidační nebo redukční vlastnosti.
- Je možné předpovědět směr OVR. Je známo, že provoz galvanického článku probíhá za předpokladu, že potenciálový rozdíl má kladnou hodnotu. Tok ORR ve zvoleném směru je také možná, pokud potenciální rozdíl Má kladná hodnota. ORR postupuje směrem k slabším oxidačním činidlům a redukčním činidlům od silnějších, např. reakce
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
prakticky netěsní v dopředném směruProtože
E° (Sn 4+ / Sn 2+ ) = +0,15 V,
E° (Fe 3+ /Fe 2+ ) = +0,77 V,
Cu + Fe 2+ = Cu 2+ + Fe
není možné směrem dopředu a proudí pouze zprava doleva, protože
Při redoxním procesu se snižuje množství výchozích látek, v důsledku čehož E oxidačního činidla klesá a E redukčního činidla se zvyšuje. Na konci reakce, tzn. Když dojde k chemické rovnováze, potenciály obou procesů se vyrovnají.
- Pokud je za těchto podmínek možné několik ORR, pak jako první proběhne reakce s největším rozdílem v redoxním potenciálu.
- Pomocí referenčních údajů můžete určit EMF reakce.
Jak určit elektromotorickou sílu (EMF) reakce?
Podívejme se na pár příkladů reakcí a definujme je EMF:
Chcete-li určit EMF reakce, musíte najít rozdíl mezi potenciálem oxidačního činidla a potenciálem redukčního činidla
EMF = E 0 ca — E 0 obnovit
- EMF = – 0,44 – (- 2,36) = 1,92 V
- EMF = 0,00 – (- 2,36) = 2,36 V
- EMF = + 0,34 – (- 2,36) = 2,70 V
Mohou nastat všechny výše uvedené reakce v dopředném směru, protože jejich EMF > 0.
Vztah mezi rovnovážnou konstantou a redox potenciálem
Pokud je potřeba určit stupeň reakce, můžete použít rovnovážná konstanta.
Například za reakci
Zn + Cu 2+ = Zn 2+ + Cu
Použití zákon hromadné akce, můžeme psát
Zde rovnovážná konstanta K ukazuje rovnovážný poměr koncentrací iontů zinku a mědi.
Hodnotu rovnovážné konstanty lze vypočítat aplikací Nernstova rovnice
Dosadíme do rovnice hodnoty standardních potenciálů párů Zn/Zn 2+ a Cu/Cu 2+ a najdeme
Ve stavu rovnováhy E 0 Zn/Zn2+ = E 0 Cu/Cu2+, tj.
-0,76 + (0,59/2) lgCZn2 + = +0,34 + (0,59/2) logCCu2 +, kam se dostaneme
Hodnota rovnovážné konstanty ukazuje, že reakce probíhá téměř do konce, tzn. dokud koncentrace iontů mědi nebude 10 37,7krát nižší než koncentrace iontů zinku.
Rovnovážná konstanta и redox potenciál spojeno obecným vzorcem:
lgK = (E1 0-E2 0)n/0,059Kde
K – rovnovážná konstanta
E1 0 a E2 0 – standardní potenciály oxidačního činidla a redukčního činidla
n je počet elektronů odevzdaných redukčním činidlem nebo přijatých oxidačním činidlem.
Jestliže E1 0 > E2 0, pak logK > 0 a K > 1.
V důsledku toho reakce probíhá v dopředném směru (zleva doprava) a pokud je rozdíl (E1 0 – E2 0) je dostatečně velký, pak jde skoro až do konce.
Naopak, pokud E1 0 0 , pak bude K velmi malé.
Reakce probíhá opačným směrem, protože rovnováha je silně posunuta doleva. Pokud je rozdíl (E1 0 – E2 0) je nevýznamná, pak K ≈ 1 a tato reakce neproběhne do konce, pokud pro to nejsou vytvořeny potřebné podmínky.
Vědět rovnovážná konstantní hodnotabez použití experimentálních dat lze posoudit hloubku chemické reakce. Je třeba mít na paměti, že tyto standardní hodnoty potenciálu neumožňují určit rychlost, kterou reakce dosáhne rovnováhy.
Podle tabulek redoxních potenciálů je možné najít hodnoty rovnovážných konstant pro přibližně 85000 XNUMX reakcí.
Jak nakreslit schéma zapojení galvanického článku?
Zde jsou doporučení IUPAC, která je třeba dodržovat, aby bylo možné správně zapisovat obvody galvanických článků a reakce v nich probíhající:
- EMF prvku — hodnota je kladná, protože práce se provádí v galvanickém článku.
- Hodnota emf galvanického obvodu je součet potenciálových skoků na rozhraních všech fází, ale s přihlédnutím k tomu, že na anodě dochází k oxidaci, se hodnota anodového potenciálu odečte od hodnoty katodového potenciálu.
Tedy při sestavování obvodu galvanického článku vlevo zaznamenejte elektrodu, na které se vyskytuje oxidační proces (anoda), а vpravo – elektroda, na které se vyskytuje redukční proces (katoda).
- Rozhraní označeno jedním řádkem – |
- Elektrolytový můstek na rozhraní dvou vodičů je označeno dvěma čarami – ||
- Roztoky, ve kterých je ponořen elektrolytický můstek se píší vlevo a vpravo od něj (v případě potřeby je zde uvedena i koncentrace roztoků). Složky jedné fáze se píší oddělené čárkami.
Pojďme například skládat schéma galvanického článku, ve kterém dochází k následující reakci:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
V galvanickém článku je anodou železná elektroda a katodou je kadmiová elektroda.
Anoda Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Cathode
Najdete zde typické úlohy pro sestavení obvodů galvanického článku a výpočet EMF reakce s řešeními zde.
Nadpisy
- OBECNÁ CHEMIE
- Základní pojmy a zákony chemie
- Struktura atomů prvků
- Periodický zákon D.I.Mendělejeva
- Chemická vazba a molekulární struktura
- Základy termodynamiky
- Chemická kinetika a rovnováha chemické reakce
- Řešení
- Redoxní reakce
- Elektrolýza
- Koroze kovů
- Složitá spojení
- Disperzní systémy. Koloidní roztoky
- Skupina I (alkalické kovy)
- Skupina II (kovy alkalických zemin)
- Skupina III (hliník)
- Skupina IV (uhlík, křemík)
- Skupina V (dusík, fosfor)
- Skupina VI (kyslík, síra)
- Skupina VII (halogeny)
- Stručná historie organické chemie
- Teorie struktury A.M. Butlerov
- Klasifikace organických sloučenin
- Izomerie a nomenklatura organických sloučenin
- Typy chemických reakcí
- Alkanes
- Alkeny, alkadieny
- alkyny
- Alkoholy
- ethery
- Aldehydy, ketony
- Karboxylové kyseliny a estery
potenciál Potenciály elektrod nejsou konstantní, závisí na aktivitě oxidovaných a redukovaných forem látky, teplotě, povaze rozpouštědla a pH prostředí. Podívejme se na tyto závislosti. Povaha elektrody a elektrolytu (včetně povahy rozpouštědla). Dále budeme podrobně analyzovat redoxní vlastnosti různých látek, ale zatím – jen několik úvah pomocí nejjednoduššího příkladu rovnováhy kovu s roztokem jeho soli: M(TELEVIZE) +m H2O(F) = [M(OH2)m] n + (F) + nē. Na první pohled se může zdát, že tento proces je podobný procesu atomové ionizace: M(d) = Mn+ (d) + nē. Energie potřebná k odstranění elektronu z atomu se nazývá ionizační potenciál I (a zde součet n ionizačních potenciálů). Čím nižší I a nižší j, tím snadněji se kov vzdává elektronů, tím silnější je redukční činidlo. Ionizační potenciál a potenciál elektrody jsou však různé veličiny, které odpovídají různým procesům. V prvním případě je iont tvořen z izolovaného (plynného) atomu a ve druhém jsou atomy vázány v pevnou látku a často velmi pevně. K získání volných atomů z pevného kovu je třeba vynaložit atomizační energii. Čím je větší, tím je kov méně aktivní. Iont je v prvním případě také plynný a ve druhém solvatovaný. Během solvatace se uvolňuje větší energie, proto se zvýšením ½ DNsolv.½ regenerační vlastnosti jsou zlepšeny. Konečně, elektrony v prvním případě jsou plynné a ve druhém jsou vázány v kovu a jejich energie se liší ve funkci práce elektronů. Elektrodové potenciály kovů tedy závisí nejen na atomových vlastnostech, ale také na síle vazeb atomů a elektronů v jednoduché látce a na solvatační energii. Pokud je elektroda inertní (nespotřebovává se ani netvoří, jako Pt ve vodíkové elektrodě), její povaha to neovlivňuje rovnováha potenciál, ale ovlivňuje rychlost nastolení rovnováhy. Zde je elektroda katalyzátorem. Proto se místo termínu „elektrodový potenciál“ často používá „oxidačně-redukční potenciál“ nebo „redoxní potenciál“. Koncentrace nebo parciální tlaky oxidovaných a redukovaných forem. Podle Le Chatelierova principu je to kvalitativně jasné: čím vyšší je koncentrace oxidované formy a čím nižší je koncentrace redukované formy, tím silněji tento systém přitahuje elektrony, tzn. tím vyšší E. Kvantitativní závislost je dána rovnicí: j = j 0 +
![]() , kde R a T jsou plynová konstanta a teplota, n je počet elektronů přenesených při elektrodové reakci, [Ox] je koncentrace (přesněji aktivita) nebo tlak oxidované formy na stupeň odpovídající stechiometrickému koeficientu (a zde se bere v úvahu nejen samotné okysličovadlo, ale obecně jsou všechna činidla na stejné straně rovnice s oxidačním činidlem) a [Červená] je stejná pro redukovanou formu, j 0 je standardní elektroda potenciál. Závislost potenciálu elektrody na koncentraci (aktivitě) iontů a teplotě vyjadřuje Nernstova rovnice pro jednotlivou elektrodu. Pro kovovou elektrodu j
, kde R a T jsou plynová konstanta a teplota, n je počet elektronů přenesených při elektrodové reakci, [Ox] je koncentrace (přesněji aktivita) nebo tlak oxidované formy na stupeň odpovídající stechiometrickému koeficientu (a zde se bere v úvahu nejen samotné okysličovadlo, ale obecně jsou všechna činidla na stejné straně rovnice s oxidačním činidlem) a [Červená] je stejná pro redukovanou formu, j 0 je standardní elektroda potenciál. Závislost potenciálu elektrody na koncentraci (aktivitě) iontů a teplotě vyjadřuje Nernstova rovnice pro jednotlivou elektrodu. Pro kovovou elektrodu j ![]() = j
= j ![]()
![]() +
+ ![]() . Přechod od přirozeného logaritmu k desítkovému a nahrazení číselných hodnot F, R a T = 298 K, získáme tvar Nernstovy rovnice vhodný pro výpočty při této teplotě: j Ox/červená = E
. Přechod od přirozeného logaritmu k desítkovému a nahrazení číselných hodnot F, R a T = 298 K, získáme tvar Nernstovy rovnice vhodný pro výpočty při této teplotě: j Ox/červená = E ![]() +
+ ![]() . Předpokládá se, že aktivita (koncentrace) pevné látky je rovna jednotce, proto je v případě námi uvažované kovové elektrody Nernstova rovnice zjednodušena: j
. Předpokládá se, že aktivita (koncentrace) pevné látky je rovna jednotce, proto je v případě námi uvažované kovové elektrody Nernstova rovnice zjednodušena: j ![]() = j
= j ![]()
![]() +
+ ![]() lg aM n + . (7) Potenciál elektrody, jak je patrné z této rovnice, závisí na aktivitě iontů, které určují potenciál. Je třeba zdůraznit, že:
lg aM n + . (7) Potenciál elektrody, jak je patrné z této rovnice, závisí na aktivitě iontů, které určují potenciál. Je třeba zdůraznit, že:- bylo dohodnuto, že Nernstova rovnice samostatné elektrody bude napsána pro redukční proces bez ohledu na to, kterým směrem se rovnováha posune, to znamená, že pod znaménkem logaritmu v Nernstově rovnici je čitatel oxidovaná forma činidla, a redukovaný tvar je ve jmenovateli;
- ve zlomkovém indexu pro j a j ° Oxidovaná forma poloprvku je umístěna nad čarou a redukovaná forma je umístěna pod čarou;
- Aktivity pevných látek nejsou zahrnuty v Nernstově rovnici.
Вsloučit pHna redoxních vlastnostech a směru ORR. Ve vodných roztocích se koncentrace vodíkových iontů pohybuje ve velmi širokém rozmezí – od několika mol/l (v kyselých roztocích) po 10 -14 mol/l (v alkalických roztocích), tedy o 14 řádů. Pokud se tedy vodíkové ionty nebo hydroxidové ionty tvoří nebo spotřebovávají v ORR, pak pH značně ovlivňuje směr takových reakcí. Podívejme se jako příklad na tři možnosti získávání manganistanu. (1) MnO4 — +8H++5e = Mn2+ + 4H2Ó; j 0 1 = 1,51 V; (2) MnO4 — +4H++3e = MnO2 + 2H2Ó; j 0 2 = 1,69 V; (3) MnO4 — + e = MnO4 2-; j 0 3 = 0,56 V. j1= j°1 + (0,059/5) log([MnO4 — ][H+]8/[Mn2+]) j1 = 1,51 + (0,059/5) log([MnO4 -]/[Mn2+]) – (8 x 0,059/5) pH.
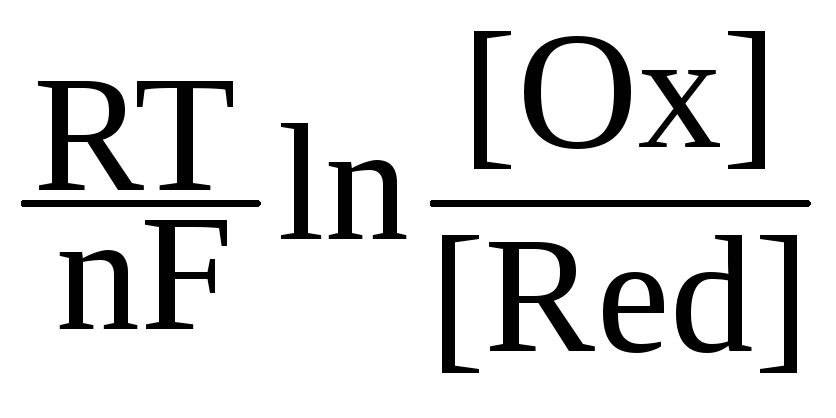 , kde R a T jsou plynová konstanta a teplota, n je počet elektronů přenesených při elektrodové reakci, [Ox] je koncentrace (přesněji aktivita) nebo tlak oxidované formy na stupeň odpovídající stechiometrickému koeficientu (a zde se bere v úvahu nejen samotné okysličovadlo, ale obecně jsou všechna činidla na stejné straně rovnice s oxidačním činidlem) a [Červená] je stejná pro redukovanou formu, j 0 je standardní elektroda potenciál. Závislost potenciálu elektrody na koncentraci (aktivitě) iontů a teplotě vyjadřuje Nernstova rovnice pro jednotlivou elektrodu. Pro kovovou elektrodu j
, kde R a T jsou plynová konstanta a teplota, n je počet elektronů přenesených při elektrodové reakci, [Ox] je koncentrace (přesněji aktivita) nebo tlak oxidované formy na stupeň odpovídající stechiometrickému koeficientu (a zde se bere v úvahu nejen samotné okysličovadlo, ale obecně jsou všechna činidla na stejné straně rovnice s oxidačním činidlem) a [Červená] je stejná pro redukovanou formu, j 0 je standardní elektroda potenciál. Závislost potenciálu elektrody na koncentraci (aktivitě) iontů a teplotě vyjadřuje Nernstova rovnice pro jednotlivou elektrodu. Pro kovovou elektrodu j  = j
= j 
 +
+  . Přechod od přirozeného logaritmu k desítkovému a nahrazení číselných hodnot F, R a T = 298 K, získáme tvar Nernstovy rovnice vhodný pro výpočty při této teplotě: j Ox/červená = E
. Přechod od přirozeného logaritmu k desítkovému a nahrazení číselných hodnot F, R a T = 298 K, získáme tvar Nernstovy rovnice vhodný pro výpočty při této teplotě: j Ox/červená = E  +
+  . Předpokládá se, že aktivita (koncentrace) pevné látky je rovna jednotce, proto je v případě námi uvažované kovové elektrody Nernstova rovnice zjednodušena: j
. Předpokládá se, že aktivita (koncentrace) pevné látky je rovna jednotce, proto je v případě námi uvažované kovové elektrody Nernstova rovnice zjednodušena: j  = j
= j 
 +
+  lg aM n + . (7) Potenciál elektrody, jak je patrné z této rovnice, závisí na aktivitě iontů, které určují potenciál. Je třeba zdůraznit, že:
lg aM n + . (7) Potenciál elektrody, jak je patrné z této rovnice, závisí na aktivitě iontů, které určují potenciál. Je třeba zdůraznit, že:













