Kvalitu vody v jezírku ovlivňuje několik chemikálií. Koncentrace oxidu uhličitého, pH, alkalita a tvrdost spolu souvisí a mají velký vliv na produktivitu jezírka, úroveň stresu, zdraví ryb, množství dostupného kyslíku a toxicitu amonia a některých kovů. Většina vlastností vody není konstantní. Koncentrace oxidu uhličitého a pH podléhají každodenním výkyvům. Alkalita a tvrdost jsou relativně stabilní, ale mohou se v průběhu času měnit, obvykle v průběhu týdnů a měsíců. Jejich stabilita závisí na pH nebo minerálním složení vodního sloupce a spodní horniny.
pH a oxid uhličitý
Hodnota pH vám řekne, zda je voda kyselá nebo zásaditá. Označuje koncentraci vodíkových iontů ve vodě a představuje její záporný dekadický logaritmus – -log[H + ]. Voda je považována za kyselou, pokud je pH nižší než 7 jednotek, a za alkalickou, pokud je vyšší než 7. Hodnoty pH se obvykle pohybují od 0 do 14 jednotek. V akvakultuře je rozsah kyselosti 6.5-9.0.
Ryby a jiní obratlovci mají krev s hodnotou pH 7.4. Krev ryb je v těsném kontaktu s vodou (rozhraní tvoří 1-2 buněčné vrstvy). V jezírku se doporučuje udržovat rozmezí blízké pH rybí krve – 7.0-8.0. Pokud pH klesne pod 5 nebo stoupne nad 10 (tj. nízká zásaditost spojená s aktivní fotosyntézou řas), rybě se udělá špatně a uhyne.
Hodnoty pH jezírka se během dne mění. V noci se koncentrace rozpuštěného kyslíku snižuje, protože se fotosyntéza zastaví, rostliny a živočichové dýchají a spotřebovávají kyslík. Při těsné výsadbě se koncentrace oxidu uhličitého zvyšuje v důsledku dýchání. Zdarma CO2 reaguje s vodou za vzniku kyseliny uhličité (H2CO3) a pH se snižuje:
Tabulka shrnuje relativní změny koncentrace rozpuštěného kyslíku, CO2 a pH do 24 hodin
| čas | Rozpuštěného kyslíku | Rozpuštěný oxid uhličitý | pH |
| den | Vzrůstající | Snižuje se | Vzrůstající |
| noční | Snižuje se | Vzrůstající | Snižuje se |
Oxid uhličitý má zřídka přímý toxický účinek na ryby. Jeho vysoké koncentrace však snižují pH a snížením pH v krvi žáber omezují schopnost rybí krve přenášet kyslík. Při dané koncentraci kyslíku (např. 2 mg/l) se mohou ryby při hladinách CO udusit2 vysoké, nebo zůstanou nezraněny při hladinách CO2 krátký. Sumci jsou tolerantní ke koncentracím CO2 20-30 mg/l, pokud se plyn hromadí postupně a hladina kyslíku je 5 mg/l. V nádrži nebo přírodním rybníku je koncentrace CO2 zřídka překračuje 5-10 mg/l.
Vysoké koncentrace oxidu uhličitého jsou téměř vždy způsobeny nízkými koncentracemi rozpuštěného kyslíku (vysoká respirační aktivita). Pro zvýšení nízkých hodnot kyslíku se voda provzdušňuje. Pomáhá také snižovat vysoké hladiny CO2v důsledku reverzní difúze plynu do atmosféry. Chronicky vysoká koncentrace CO2 snížení přidáním hydratovaného vápna Ca(OH)2. Přibližně 1 mg/l vápna odstraní 1 mg/l oxidu uhličitého. Toto ošetření by však nemělo být prováděno ve vodě se špatnými pufrovacími vlastnostmi (nízká zásaditost), protože pH stoupne na úrovně smrtelné pro ryby. Kromě toho existuje nebezpečí pro ryby, pokud se do vody s nadměrným množstvím amonia přidá vápno. Vysoké pH zesiluje toxické účinky amonia.
Alkalita
Celková alkalita popisuje množství zásad přítomných ve vodě. Obvykle jsou v jezírku přítomny uhličitany, hydrogenuhličitany, hydroxidy, fosforečnany a boritany. Uhličitany a hydrogenuhličitany jsou nejběžnější a nejdůležitější složkou alkality. To se měří množstvím kyseliny (H+) ve vodě, které může být absorbováno (pufrováno) před dosažením určené úrovně pH. Celková alkalita se vyjadřuje v mg/l nebo ppm uhličitanu vápenatého CaCO3. Alkalita 20 mg/l je více než dostačující pro dobrou produktivitu jezírka. Je požadováno celkové rozmezí alkality 75-200 mg/l CaCO.3.
Uhličitano-bikarbonátová alkalita (a tvrdost) povrchových a studničních vod vzniká především interakcí rozpuštěného CO ve vodě2 a vápenná půda. Dešťová voda je přirozeně kyselá, protože je nasycena atmosférickým oxidem uhličitým. Jakmile projde půdou, každá kapka je nasycena CO2a pH se snižuje. Studniční voda je čerpána z velkých, přirozených podzemních nádrží (vodonosné vrstvy) nebo malých lokalizovaných oblastí podzemních vod (podzemní voda). Podzemní voda má obvykle vysokou koncentraci CO2nízké pH a koncentrace kyslíku. akumulace CO2 v nich je způsoben výskytem bakteriálních procesů v půdě a minerálními formacemi. Jakmile dešťová voda, podzemní voda prochází vrstvou obsahující vápenatý vápenec CaCO3 nebo dolomitizovaný vápenec CaMg(CO3)2, minerály se rozpouštějí za vzniku vápenatých a hořečnatých hydrogenuhličitanových solí:
V důsledku toho se zvyšuje zásaditost, kyselost a tvrdost vody.
Alkalita, pH a koncentrace oxidu uhličitého
Ve vodě se střední až vysokou alkalitou (dobrá pufrační kapacita) a podobnými úrovněmi tvrdosti bylo pH neutrální nebo mírně zásadité (7.0 – 8.3) a příliš nekolísalo. Vyšší koncentrace CO2 (tj. kyselina uhličitá) nebo jiné kyseliny vyžadují ke snížení pH více zásad, které by mohly kyselinu neutralizovat nebo pufrovat.
V tabulce můžete vidět vztah mezi alkalitou, pH a koncentrací CO2


Číslo (faktor) uvedené v tabulce a odpovídající určitým hodnotám pH a teploty se násobí hodnotou alkality (mg/l CaCO3). Výsledek této rovnice umožňuje odhadnout koncentraci CO2 (mg/l).
Například v jezírku se sumci je pH = 7.2, teplota = 25 °C a celková alkalita = 103 mg/l. Hodnota faktoru = 0.124. Koncentrace oxidu uhličitého = 0.124 x 103 mg/l alkalita = 12.8 mg/l CO2.
Aby se minimalizovala chyba v těchto výpočtech, mělo by se pH zaznamenávat po dobu 30 minut. Vzhledem k několika zdrojům chyb je preferováno přímé měření koncentrací oxidu uhličitého pomocí chemických testů.
Alkalita, pH a fotosyntéza
Zásady, které způsobují alkalitu, také neutralizují kyseliny. Uhličitany a hydrogenuhličitany mohou reagovat s kyselinami a zásadami a vyrovnávat (minimalizovat) změny pH v prostředí. Kyselost vody s vysokými pufračními vlastnostmi se pohybuje v rozmezí 6.9-9 jednotek. Ve vodě s nízkými pufračními vlastnostmi může pH dosahovat až alarmivně nízkých hodnot (díky dýchání vzniká oxid uhličitý a kyselina uhličitá) nebo alarmujících vysokých hodnot (vysoká fotosyntetická aktivita).
Fytoplankton jsou mikroskopické nebo téměř mikroskopické vodní rostliny odpovědné za produkci významné části kyslíku v jezírku a provádění fotosyntézy. Když je pH stabilní kolem 6.5 nebo vyšší, zásaditost zlepšuje produktivitu fytoplanktonu, protože zvyšuje dostupnost živin (rozpustné fosfáty). Alkalita nad 20 mg/l zachycuje CO2 a zvyšuje jeho koncentraci dostupnou pro fotosyntézu.
Protože fytoplankton používá CO2 Při fotosyntéze se pH ve vodě zvyšuje se snižující se koncentrací oxidu uhličitého a kyseliny uhličité. Kromě toho fytoplankton a další rostliny přeměňují hydrogenuhličitany (HCO3 – ) na oxid uhličitý pro fotosyntézu a uvolňuje uhličitany:
Vysoké hodnoty pH mohou také způsobit pokles koncentrace H +:
CO3 -2 + H+ = HCO3 – nebo
HCO3 — + H + = H2O + CO2
Uhličitan uvolněný z bikarbonátu prostřednictvím rostlinné biomasy může způsobit výrazné zvýšení pH (nad 9) v období aktivní fotosyntézy fytoplanktonu. Toto zvýšení pH je pozorováno ve vodě s nízkou alkalitou (20-50 mg/l) nebo ve vodě se střední až vysokou uhličitanovou alkalitou (75-200 mg/l) a tvrdostí nižší než 25 mg/l. Vysoká bikarbonátová alkalita v měkké vodě je způsobena uhličitany sodnými a draselnými, které jsou ve vodě rozpustnější než uhličitany vápenaté a hořečnaté, které přispívají k tvrdosti. Pokud je přítomen vápník, hořčík a výsledný fotosyntetický uhličitan, při pH nad 8.3 se tvoří vápenec. V jezírkách s alkalitou pod 20 mg/l obvykle nedochází k propuknutí řas a výslednému zvýšení pH způsobenému fotosyntézou.
Tvrdost
Tvrdost je důležitým ukazatelem vody při pěstování ryb. Obvykle se vyskytuje v hydrochemické analýze. Tvrdost je dána koncentrací dvojmocných iontů – vápníku, hořčíku a/nebo železa. Může obsahovat směs dvojmocných solí, ale vždy převažuje vápník a hořčík.
Tradičně se tvrdost měří chemickou titrací. Tvrdost vzorků vody je vyjádřena v miligramech na litr ekvivalentu uhličitanu vápenatého (mg/l CaCO3). Uhličitanová tvrdost je hlavním ukazatelem množství dvojmocných solí, který nerozlišuje vápník, hořčík a soli ostatních dvojmocných prvků.
Tvrdost je často zaměňována s alkalitou (celková koncentrace báze). Vzniká zmatek, protože oba parametry jsou měřeny v mg/l ekvivalentu CaCO3. Pokud je vápenec zodpovědný za tvrdost i alkalitu, budou jejich koncentrace podobné. Pokud však v roztoku, kde je alkalita ovlivněna NaHCO3, bude tvrdost nízká a alkalita naopak vysoká. Kyselé, podzemní a studniční vody mohou mít nízkou nebo vysokou tvrdost a velmi nízkou zásaditost (nebo žádnou zásaditost).
Vápník a hořčík jsou důležité pro řadu biologických procesů v těle ryb (tvorba kostí a šupin, srážení krve a další metabolické reakce). Ryby jsou schopny přijímat vápník a hořčík přímo z vody nebo prostřednictvím potravy.
Vápník je nejdůležitějším dvojmocným prvkem v kultivační vodě. Přítomnost volného (iontového) vápníku ve vodě pomáhá snižovat ztráty jiných solí (tj. sodíku a draslíku) z vnitřních tekutin ryb (krev). Sodík a draslík jsou součástí krve ryb. Podílejí se na řadě procesů, včetně srdeční činnosti, inervace a svalové činnosti. Výzkum ukázal, že vápník z okolního prostředí je také nezbytný pro reabsorpci ztracených sodných a draselných solí. Ve vodě s nízkou koncentrací vápníku může do vody unikat značné množství sodíku a draslíku. Pro sekundární absorpci těchto prvků je vynaložena tělesná energie. U některých druhů ryb (Sciaenops ocellatus, Morone saxatilis) je vysoká hodnota tvrdosti vápníku důležitá pro přežití.
Doporučený rozsah volného vápníku v kultivační vodě je 25-100 mg/l (65-250 mg/l CaCO3). Kanálský sumec snáší nízké koncentrace vápníku, pokud jejich potrava obsahuje minimální množství vápníku, ale rychlost jejich růstu je nízká. Stejně tak pstruh duhový snáší nízké koncentrace vápníku (10 mg/l), pokud je pH nad 6.5. Pro pěstování Sciaenops ocellatus, Morone saxatilis nebo raků je žádoucí koncentrace volného vápníku 40-100 mg/l (100-250 mg/l CaCO).3), což odpovídá koncentraci vápníku v krvi ryb (100 mg/l Ca nebo 250 mg/l CaCO3). Tvrdost vodních zdrojů pro tyto druhy by měla být testována.
Nízká uhličitanová tvrdost je spolehlivým indikátorem nízkého obsahu vápníku. Vysoká tvrdost však nemusí nutně odrážet vysokou koncentraci tohoto prvku.
Uhličitanová tvrdost 100 mg/l zahrnuje 40 mg/l volného vápníku (rozdělte CaCO3 dne 2.5), pokud je způsobena pouze přítomností vápníku. Podobně, pokud je hodnota uhličitanové tvrdosti 100 mg/l a je reprezentována volným hořčíkem, je koncentrace hořčíku 24 mg/l (dělení CaCO3 dne 4.12). Tyto faktory (2.5 a 4.12) souvisí s molekulovou hmotností CaCO3 a rozdíly v hmotnosti atomů hořčíku a vápníku. Tam, kde je tvrdost způsobena přítomností vápence, hodnota CaCO3 obvykle odráží směs volného vápníku a hořčíku. Ve směsi ale stále převládá hořčík.
Vápenec může být použit v zemědělství ke zvýšení koncentrace vápníku (a uhličitanově-hydrogenuhličitanové tvrdosti) v oblastech s kyselou vodou nebo půdou. Při pH 8.3 nebo vyšším se však vápenec nerozpouští. Měkká alkalická voda může být obohacena vápníkem pomocí sádry (CaSO4) nebo CaCl2. Velké objemy úpravy mohou mít za následek značné náklady a může být praktičtější najít jiný zdroj vody.
Vliv pH, alkality a tvrdosti na toxicitu amonia a kovů
Amonium se stává toxičtější se zvyšujícím se pH. Vysoké koncentrace toxické neionizované formy amonia (NH3) vznikají v zásadité vodě, zatímco NH4 + převládá v kyselé vodě. Protože alkalita se zvyšuje s pH, amonium se ve vodě s vysokou celkovou alkalitou stává toxičtější. Tvrdost není obvykle spojena s toxicitou amonia.
Kovy jako měď a zinek jsou běžnější v domácnostech (v bazénech, vodovodních armaturách a CuSO4). Stávají se lépe rozpustnými v kyselé vodě. Rozpustnost nebo volná ionizovaná forma těchto kovů je pro ryby toxická. Vysoká celková alkalita zvyšuje pH a dostupnost báze, což podporuje tvorbu méně toxických nerozpustných forem mědi a zinku. Vysoké koncentrace vápníku a hořčíku (tvrdost) blokují účinky mědi a zinku v místech toxického vlivu. Proto jsou tyto kovy pro ryby toxičtější v měkké, kyselé vodě s nízkou celkovou alkalitou.
V ideálním případě by akvakulturní jezírko mělo mít pH 6.5-9.0, střední až vysokou alkalitu (75-200 mg/l, ale ne méně než 20 mg/l) a tvrdost uhličitanu vápenatého 100-200 mg/l CaCO3. Mnoho principů chemie je abstraktních (pufrování, uhličitan-bikarbonát) a těžko pochopitelné. Ale základní pochopení vztahu mezi pH, CO2zásaditost a tvrdost jsou zásadní pro efektivní řízení akvakultury.
–
www2.ca.uky.edu/wkrec/interactionsphetc.pdf
William A. Wurts a Robert M. Durborow. Interakce pH, oxidu uhličitého, zásaditosti a tvrdosti v rybnících. Jižní regionální centrum akvakultury. Publikace SRAC č. 464. 2012.

Rostliny se skládají ze 40 – 50 % uhlíku [C] (suchá hmotnost) a v akváriu bez zásoby CO2 je jeho množství tak malé, že prostě nemají kde získat hlavní stavební materiál pro své buňky. Rostliny využívají k fotosyntéze světelnou energii, kyslík, uhlík a vodík. Prostřednictvím fotosyntézy se sacharidy, jako je glukóza, vyrábějí z oxidu uhličitého CO2 reakcí:
CO2 + 6 H2O + 674.000 6 cal (sluneční energie) → C12H6O6 + 2HXNUMXO
CO2 + 2H2O -> [CH2O] + O2 + H2O
Jak vidíte, bez dostatečného množství CO2 to nejde. Tento vzorec také ukazuje, že proces fotosyntézy rostlin vyžaduje určitou úroveň světelné energie (~ 674.000 XNUMX cal). Pokud světlo není dostatečně jasné, nedojde k fotosyntéze. Při hladinách světla blízkých optimálnímu bude fotosyntéza probíhat rychleji a rychleji.

Proč CO2?
Uhlík je rostlinám dostupný ve dvou formách: plynný jako oxid uhelnatý [CO2] a rozpuštěný ve vodě jako hydrogenuhličitan [HCO3-]. Rostliny raději nespotřebovávají CO2 z hydrogenuhličitanu, ale jako čistý CO2 bez vysokých energetických nákladů, navíc mnoho rostlin neumí přímo využít hydrogenuhličitan pro fotosyntézu. Oxid uhelnatý (CO2) rozpuštěný ve vodě poskytuje rostlinám nejlepší a nejsnáze asimilovaný zdroj uhlíku.
 CO2 a kyslíku
CO2 a kyslíku
Na rozdíl od všeobecného přesvědčení oxid uhličitý nevytlačuje kyslík z vody a neomezuje jeho dostupnost pro ryby k dýchání – úspěšně koexistují. Naopak díky dobrému růstu rostlin dosahuje koncentrace kyslíku během dne, kdy rostliny aktivně fotosyntetizují, 11 mg/l, což je mnohem více než limit 100% nasycení při teplotě vody 24°C a ráno klesá pouze na 8 mg/l. Pro normální život ryb stačí koncentrace rozpuštěného kyslíku ve vodě 5 mg/l (60% nasycení).

Rovnováha světla a CO2
Intenzita světla a přívod CO2 musí být sladěné. Příliš mnoho světla bez dostatečného přísunu CO2 rostlinám pouze škodí. Rostlinná fotosyntéza nevyžaduje vždy hodně CO2, jak lze vidět ze vzorce pro fotosyntézu:
6 CO2 + 12 H2O → C6H12O6 + 6 H2O
Rostliny přitom mohou uvolňovat kyslík (aktivně fotosyntetizovat) i BEZ přísunu živin! To ale nemůže trvat dlouho. Rostliny budou i přes aktivní fotosyntézu stále slabší. Zároveň se snižuje jejich spotřeba fosfátů a dusíku z vody a řasy toho okamžitě využijí. Pokud je hodně světla, ale málo CO2, rostliny nebudou aktivně růst a objeví se řasy. Aplikace kapalných hnojiv problém dále zhorší. Na druhou stranu, pokud není dostatek světla a je dodáváno hodně CO2, rostliny CO2 nespotřebovávají a jeho koncentrace může překročit přípustný limit a stát se toxickým pro ryby a bezobratlé (> 30 mg/l).
Některé rostliny jsou světlomilnější než jiné, například dlouhostébelné rostliny s velmi tenkými listy. Vyžadují více světla, a proto vyžadují více CO2! Neexistují žádné složité nebo jednoduché rostliny, jsou prostě světlomilné a stínomilné – kromě různého potřebného množství světla a CO2 se neliší. Již od počátku tvorby je nutné stanovit výkon zářivek (od 0.5 do 1 W/litr) a přísun CO2, aby tyto faktory v budoucnu nesnižovaly růst rostlin – bude snazší určit jejich potřebu dalších živin.

Kolik CO2 dodávat? Jak udělat pH vody a nasycení CO2 ideální pro rostliny?

Pokud v akváriu dosáhnete KH = 4° a upravíte přísun CO2 tak, aby bylo pH nastaveno na 6.8 ráno a 7.2 večer, bude výsledná průměrná koncentrace CO2 ~ 15 – 30 mg/l. pH a KH jsou něco, co každý, kdo má akvárium s rostlinami, musí bezpodmínečně pochopit, dva vzájemně propojené pojmy. pH je měřítkem kyselosti vody. Je určeno záporným logaritmem množství hydroxidových iontů (H+) ve vodě – čím více jich je, tím je pH nižší. Reakce pH vody může být kyselá (pH 7.0).
Uhličitanová tvrdost KH je měřítkem alkality vody. KH označuje schopnost udržovat pH na určité úrovni, to znamená, že je indikátorem pufračních vlastností vody. Neustále se mění, proto se nazývá dočasná rigidita. Hodnota KH je množství hydrogenuhličitanu [HCO3—] ve vodě, které neutralizuje účinky kyselin, které se neustále tvoří v akváriu, jako jsou dusičnany, snižující pH, a tím zabraňuje poklesu pH. Čím více hydrogenuhličitanů [HCO3—] ve vodě (přidáním CO2), tím nižší je hodnota pH.

CO2 snižuje pH
Při přívodu CO2 do akvária se ve vodě tvoří malé množství kyseliny uhličité [H2CO3] (0.1 – 0.2 %), která se disociuje na iont [H+] a hydrogenuhličitan [HCO3-] (základ KH), koncentrace iontů H+ se zvyšuje, což snižuje pH – což znamená dodávání Pomocí CO2 můžeme snížit pH v akváriu a zároveň poskytnout nejdůležitější živinu pro růst rostlin – uhlík [C]. S poklesem pH ve vodě se zvyšuje podíl uhlíku ve formě CO2. Vzhledem k tomu, že hodnota pH je ovlivněna uhličitanovým pufrem KH a koncentrací CO2 ve vodě, vztah je striktní.
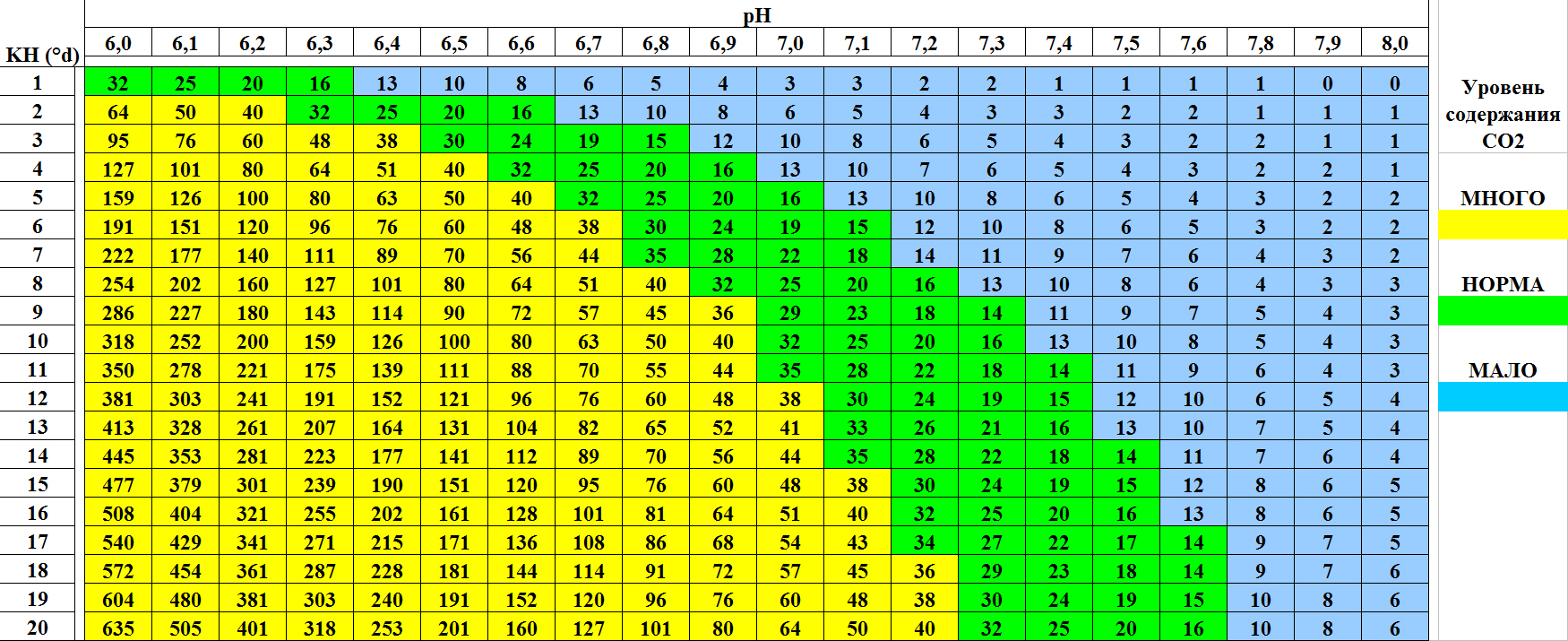
Vzhledem k tomu, že pH je určeno především přítomností uhličitanového pufru KH, závisí množství dodávaného CO2 na tom, jakou úroveň pH chceme v osázeném akváriu. To znamená, že ve třech jsou uvedeny hodnoty pH a KH a přísun CO2 bude regulován tak, aby byla současně zajištěna optimální úroveň pH = 6.8 – 7.2 a koncentrace oxidu uhličitého ve vodě. Pro dosažení optimální koncentrace CO2 = 15 – 30 mg/l a pH = 6.8 – 7.2 musí mít voda počáteční KH = 2 – 8, což odpovídá vodě s celkovou tvrdostí dGH = 4 – 10.

Zvětrávání CO2
Oxid uhličitý se z vody odstraňuje velmi snadno, stejně snadno jako při protřepávání lahví s perlivou vodou, proto je vhodné omezit pohyb hladiny vody. Pro tohle:
- NIKDY Provzdušňování vody nepoužívejte, v akváriu s rostlinami to prostě není potřeba!
- Výstup kanystrového filtru vždy umístěte pod hladinu vody.
- Na výstupu vody z filtru do akvária nepoužívejte flétnu.
- Pokud se k vytvoření proudu používají čerpadla, měla by být umístěna tak, aby omezovala pohyb vodní hladiny.
Může to být zajímavé!
- Odpovědi na nejčastější otázky – Amoniak
- Únikové chování akvarijních ryb
- Výběr živého krmiva pro ryby. Recenze 7 typů.
- UV sterilizace akvarijní vody
- Důležité! 7 základních zásad správné výživy ryb















