Řešení problémů zahrnujících ředění roztoků není nijak zvlášť obtížné, ale vyžaduje péči a určité úsilí. Přesto je možné řešení těchto problémů zjednodušit využitím zákona ředění, který se používá v analytické chemii při titracích roztoků.
Všechny knihy chemických úloh ukazují řešení problémů prezentovaných jako vzorová řešení a všechna řešení využívají zákon ředění, jehož principem je, že množství rozpuštěné látky a hmotnost m v původním a zředěném roztoku zůstávají nezměněny. Když řešíme nějaký problém, máme tuto podmínku na paměti a výpočet zapisujeme po částech a postupně se krok za krokem přibližujeme ke konečnému výsledku.
Uvažujme problém řešení problémů ředění na základě následujících úvah.
• Množství rozpuštěné látky:
kde c – molární koncentrace rozpuštěné látky v mol/l, V – objem roztoku vl.
• Hmotnost rozpuštěné látky m(r.v.):
kde m(roztok) je hmotnost roztoku vg, je hmotnostní zlomek rozpuštěné látky.
Označme množství v původním (nebo neředěném) roztoku c, V, m(r-ra), přes с1, V1,
m1(r-ra), 1a ve zředěném roztoku – skrz с2, V2, m2(r-ra), 2.
Vytvořme rovnice pro ředění roztoků. Levé strany rovnic přidělíme pro původní (neředěné) roztoky a pravé strany pro zředěné roztoky.
Konstantní množství rozpuštěné látky po zředění bude mít tvar:

Zachování hmoty m(r.v.):

Množství rozpuštěné látky souvisí s její hmotností m (r.v.) s poměrem:
kde M(r.v.) – molární hmotnost rozpuštěné látky v g/mol.
Rovnice ředění (1) a (2) spolu souvisí takto:
Pokud je v problému znám objem rozpuštěného plynu V(plyn), pak jeho látkové množství souvisí s objemem plynu (č.) poměrem:
Rovnice ředění budou mít následující tvar:
Pokud je v úloze známa hmotnost látky nebo množství látky použité k přípravě roztoku, pak na levou stranu rovnice ředění dáme m(r.v.) nebo v závislosti na podmínkách problému.
Pokud je podle podmínek úlohy nutné kombinovat roztoky různých koncentrací stejné látky, pak se na levé straně rovnice sečtou hmotnosti rozpuštěných látek.
Poměrně často problémy využívají hustotu roztoku (g/ml). Ale od molární koncentrace с se měří v mol/l, pak by měla být hustota vyjádřena vg/l a objem V – v l.
Uveďme příklady řešení „vzorových“ problémů.
1 výzva. Jaký objem 1M roztoku kyseliny sírové je třeba odebrat, abychom získali 0,5 litru 0,1M roztoku H2SO4?
Vzhledem k:
Hledat:
rozhodnutí
V1•1 = 0,5 • 0,1; V1 = 0,05 l nebo 50 ml.
Odpovědět. V1 = 50 ml.
2 výzva ([1], č. 4.23). Určete hmotnost roztoku s hmotnostním zlomkem (СuSO4) 10 % a hmotnost vody, která bude potřeba k přípravě roztoku o hmotnosti 500 g s hmotnostním zlomkem
(СuSO4) 2%.
Vzhledem k:
Hledat:
rozhodnutí
Odtud m1(roztok) = 100 g.
Zjistíme hmotnost přidané vody:
m(H2O) = 500 – 100 = 400 g.
Odpovědět. m1(roztok) = 100 g, m(H2O) = 400 g.
3 výzva ([1], č. 4.37). Jaký je objem roztoku s hmotnostním zlomkem kyseliny sírové 9,3 %
( = 1,05 g/ml) potřebné k přípravě 0,35M řešení H2SO4 objem 40 ml?
Vzhledem k:
Hledat:
rozhodnutí
Dosadíme hodnoty známých veličin:
Odtud V1 = 0,01405 l nebo 14,05 ml.
Odpovědět. V1 = 14,05 ml.
4 výzva [2]. Jaký objem chlorovodíku (NO) a vody bude potřeba k přípravě 1 litru roztoku ( = 1,05 g/cm 3 ), ve kterých je obsah chlorovodíku v hmotnostních zlomcích 0,1
(nebo 10%)?
Vzhledem k:
V(roztok) = 1 l,
(roztok) = 1050 g/l,
= 0,1,
М(HCl) = 36,5 g/mol.
Hledat:
rozhodnutí
V(HCl)/22,4= m(r-ra)•/М(HCl),
V(HCl)/22,4= V(r-ra)•(r-ra)•/М(HCl),
Odtud V(HCl) = 64,44 XNUMX.
Zjistíme hmotnost přidané vody:
m(H2O) = m(r-ra) – m(HCl),
m(H2O) = V(r-ra)•(r-ra) – V(HCl)/22,4• М(HCl),
m(H2O) = 1•1050 – 64,44/22,4•36,5 = 945 g.
Odpovědět. 64,44 l HCl a 945 g vody.
5 výzva ([1], č. 4.34). Určete molární koncentraci roztoku s hmotnostním zlomkem hydroxidu sodného 0,2 a hustotou 1,22 g/ml.
Vzhledem k:
= 0,2,
= 1220 g/l,
М(NaOH) = 40 g/mol.
Hledat:
rozhodnutí
m(velikost)• = с•V•М(NaOH),
m(velikost)• = с•m(r-ra)•М(NaOH)/.
Vydělme obě strany rovnice m(r-ra) a dosaďte číselné hodnoty veličin.
0,2 = c•40/1220.
Odtud c = 6,1 mol/l.
Odpovědět. c = 6,1 mol/l.
6 výzva ([1], č. 4.30). Určete molární koncentraci roztoku získaného rozpuštěním síranu sodného o hmotnosti 42,6 g ve vodě o hmotnosti 300 g, je-li hustota výsledného roztoku 1,12 g/ml.
Vzhledem k:
Hledat:
rozhodnutí
Dosazením číselných hodnot dostaneme:
42,6 = с•(42,6 + 300)/1120•142.
Odtud с = 0,98 mol/l.
Odpovědět. с = 0,98 mol/l.
7 výzva ([1], č. 4.19). Laboratoř disponuje roztoky s hmotnostním zlomkem chloridu sodného 10 % a 20 %. Jakou hmotnost každého roztoku je třeba vzít, abychom získali roztok s hmotnostním zlomkem soli 12 % a hmotností 300 g?
Vzhledem k:
Hledat:
rozhodnutí
Od m1(r-ra) + m2(r-ra) = 300 g, pak dostaneme soustavu dvou rovnic o dvou neznámých. Když vyřešíme dvě rovnice společně, zjistíme:
Odpovědět. m1(roztok) = 240 g, m2(roztok) = 60 g.
8 výzva ([1], č. 4.48). Ve vodě o hmotnosti 100 g o teplotě 0 °C se rozpustí fluorid sodný o hmotnosti 4,1 g a při teplotě 40 °C – o hmotnosti 4,5 g. Jaká hmotnost fluoridu sodného se vysráží při ochlazení roztoku nasyceného při teplotě 40 °C NaF o hmotnosti 500 g do teploty 0 °C?
Vzhledem k:
m1(NaF) = 4,1 g,
m2(NaF) = 4,5 g,
m2(roztok) = 500 g,
– hmotnostní zlomek NaF,
(1 – ) – hmotnostní podíl vody.
Hledat:
rozhodnutí
500•(1 – 4,5/(4,5 + 100)) = m1(roztok)•(1 – 4,1/(4,1 + 100)).
Odtud m1(r-ra) = 104,1/104,5•500 = 498,09 g,
m(NaF) = 500 – 498,09 = 1,91 g.
Odpovědět. m(NaF) = 1,91 g.
REFERENCE
1. Khomchenko G.P., Khomchenko I.G. Problémy z chemie pro uchazeče o studium na vysokých školách. M.: Nová vlna, 2002.
2. Feldman F.G., Rudzitis G.E. Chemie-9. M.: Vzdělávání, 1990, str. 166.
VÝROBCE
specializovaná chemie
Procentuální koncentrace
V chemii často používáme termíny jako „koncentrovaný roztok“, „zředěný roztok“ a „nasycený roztok“, ale ty nám dávají pouze hrubou představu o tom, kolik nebo málo látky je v roztoku. Existuje však několik způsobů, jak přesně určit, jaké je jeho kvantitativní složení. O jednom z nich se dočtete v dalším článku.

Stanovení procentuální koncentrace
Pojem koncentrace znamená množství látky přítomné v daném roztoku. Koncentraci lze udávat v jednotkách v závislosti na velikosti, kterou používáme, jako jsou moly, gramy nebo procenta. Procentuální koncentrace nám říká, kolik hmotnostních dílů rozpuštěné látky je obsaženo ve 100 hmotnostních dílech roztoku. Jinými slovy je to počet gramů rozpuštěné látky ve 100 g roztoku. Pokud kupujeme například 3,2% mléko, znamená to, že 100 g mléka obsahuje 3,2 g tuku. Procentuální koncentrace je označena symbolem “C%“.
Obecný vzorec pro procentuální koncentraci
Chcete-li odvodit vzorec procentuální koncentrace, pamatujte si to hmotnost roztoku (мřešení) – není to jen hmotnost rozpouštědla (мr-la)Ale látka v něm rozpuštěná (мin-va):
Vezmeme-li jako příklad 4% roztok o hmotnosti 100 g, víme, že C% = 4%, což znamená, že hmotnost látky je 4 g. Z definice procentuální koncentrace vyplývá, že jelikož hmotnost roztoku je 100 g, hmotnost rozpouštědla je 96 g.
Procentuální koncentraci lze vypočítat pomocí vzorce:
Ze vzorce vyplývá, že při znalosti hmotnosti roztoku a hmotnosti látky můžeme snadno vypočítat procentuální koncentraci. Například, když víme, že roztok má hmotnost 450 g a rozpuštěná látka v něm je 15 g, nahradíme ji do vzorce, dostaneme:
C% = (15/450) 100 % = 3,3 %
Výpočet hmotnosti jednotlivých složek roztoku
Převést lze jakýkoli vzorec, včetně vzorce procent. Znáte-li procentuální koncentraci roztoku a jeho hmotnost, můžete vypočítat hmotnost látky rozpuštěné v něm. Podobně, pokud znáte procentuální koncentraci a hmotnost látky, můžete vypočítat hmotnost roztoku. Kromě transformací vzorců můžete použít i vhodné proporce.
Příklad 1. Kolik gramů cukru je potřeba k přípravě 300 g 10% roztoku?
Z obsahu úlohy víme, že hmotnost roztoku je 300 g a jeho procentuální koncentrace je 10 %. Stanovení hmotnosti rozpuštěné látky je možné dvěma způsoby.
Metoda 1. Konverze vzorce
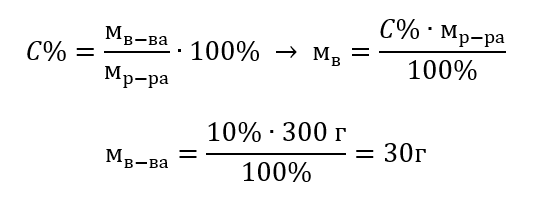
Metoda 2. Pomocí poměru s vědomím, že 10% roztok obsahuje 10 g cukru na 100 g roztoku
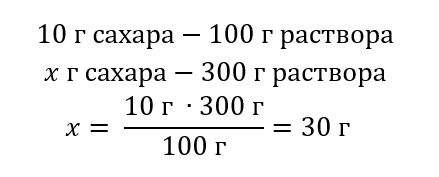
Výsledkem obou řešení je, že k přípravě 300 g 10% roztoku je potřeba použít 30 g cukru.

Příklad 2. V kolika gramech vody se musí rozpustit 10 g látky, aby vznikl 50% roztok?
Z obsahu úlohy víme, že hmotnost látky je 10 g a procentuální koncentrace roztoku je 50 %. To znamená, že 100 g roztoku obsahuje 50 g látky. Stanovení hmotnosti řešení je možné dvěma způsoby. Je třeba si uvědomit, že hmotnost roztoku se nerovná hmotnosti rozpouštědla. Chcete-li vypočítat hmotnost rozpouštědla, odečtěte hmotnost látky od hmotnosti roztoku.
Metoda 1. Převod vzorce

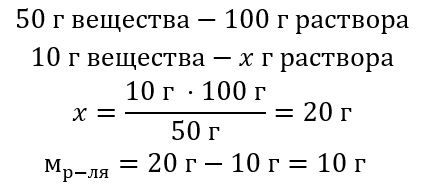
Metoda 2. Pomocí poměru s vědomím, že 100 g roztoku obsahuje 50 g látky.
Řešením problému dvěma způsoby je, že pro získání 50% roztoku je nutné rozpustit 10 g látky v 10 g vody.
Příprava roztoků
Klíčovým prvkem laboratorní práce je schopnost připravovat roztoky ve stanovených koncentracích. K tomu potřebujete znát hmotnosti jeho součástí. Dříve vypočítaná hmotnost látky by měla být rozpuštěna v přesně odměřeném objemu rozpouštědla. Požadovaný objem lze vypočítat na základě znalosti hmotnosti a hustoty kapaliny. Hustota roztoku je fyzikální veličina charakteristická pro danou kapalinu, určující její hmotnost pro konkrétní jednotku objemu. Hodnota je velmi závislá na teplotě. Když víme, že hustota roztoku je 2,03 g/ml, víme, že 1 ml tohoto roztoku má hmotnost 2,03 g. Nejběžnější jednotky hustoty jsou: g/ml = g/cm 3, g/l = g /dm 3, ale mohou se vyskytovat i jiné jednotky, například kg/m3. Hustota roztoku je určena vzorcem: dřešení=mřešení/vřešení, kde mřešení znamená hmotnost roztoku a Vřešení – jeho objem. Znáte-li objem daného roztoku a jeho hustotu, můžete vypočítat jeho hmotnost.
Příklad 3. Jakou hmotnost má 20 ml roztoku, jehož hustota je 1,201 g/ml?
Metoda 1. Převod vzorce
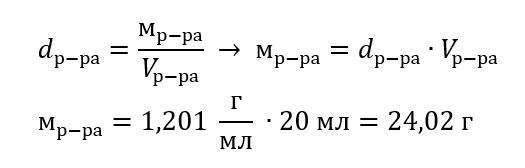
Metoda 2. Pomocí poměru s vědomím, že 1,201 g roztoku zabírá objem 1 ml

Obě metody ukázaly, že roztok o hustotě 1,201 g/ml, který zabírá 20 ml, má hmotnost 24,02 g.
Znalost pojmu hustota nám umožňuje provádět ještě více výpočtů na základě procentuální koncentrace.
Příklad 4. Kolik gramů soli obsahuje 10 ml roztoku o koncentraci 15 %, je-li jeho hustota 1,035 g/ml?
Metoda 1. Převádění vzorců

Metoda 2. Použití proporce

Obě metody ukázaly, že pro přípravu 10 ml roztoku s C% = 15%, hustotou 1,035 g/ml je potřeba navážit 1,553 g soli.
Příklad 5. Jaká je procentuální koncentrace roztoku získaného rozpuštěním 40 g látky ve 200 ml ethanolu o hustotě 0,78 g/ml?
K výpočtu úlohy můžete použít převod vzorce na procentuální koncentraci. Hmotnost roztoku můžeme vypočítat sečtením hmotnosti rozpuštěné látky a hmotnosti rozpouštědla. Vzhledem k tomu, že obsah úlohy neudává hmotnost rozpouštědla, ale jeho hustotu a objem, lze chybějící údaje dopočítat převodem vzorce na hustotu.

- Stanovení procentuální koncentrace
- Obecný vzorec pro procentuální koncentraci
- Výpočet hmotnosti jednotlivých složek roztoku
- Příprava roztoků
















