Písmena pH najdeme na kelímku krému na obličej, ve výsledcích lékařských testů, ve zprávě ekologa nebo průmyslového inženýra. Pojďme zjistit, co je tento všudypřítomný ukazatel, jak jej vypočítat a použít.
· Aktualizováno 25. října 2022
Co je pH a proč je potřeba?
Vodné roztoky látek mohou být kyselé, neutrální nebo zásadité. Kyselost prostředí závisí na vzájemné koncentraci kladně nabitých vodíkových iontů (H + ) a záporně nabitých hydroxidových iontů (OH − ).
Je-li v roztoku [H + ] > [OH − ], pak se nazývá kyselý,
pokud [OH − ] > [H + ] — zásadité,
pokud [H + ] = [OH − ] — neutrální.
V neutrálním roztoku je koncentrace H + a OH − zanedbatelná, protože tyto ionty spolu aktivně interagují za vzniku nízkodisociační sloučeniny H2A. Proto jsou v neutrálním roztoku přítomny pouze ty vodíkové ionty a hydroxidové ionty, které vznikly jako výsledek reverzibilní disociace:
Disociační konstanta je nevýznamná a rovná se:
Koncentrace vody se v roztoku prakticky nemění, takže výraz pro disociační konstantu vody můžeme zjednodušit:
Výsledný výraz se nazývá iontový produkt vody. Tato hodnota je při dané teplotě konstantní (pro T = 22–25 °C Kw = 10 −14 ) pro vodu a její roztoky.
Koncentrace iontů H + a OH − při pokojové teplotě je vždy stejná a rovná se:
[H+] = [OH -] = 10 -7 mol/l.
Pro charakterizaci kyselosti média je vhodnější použít hodnota PH (čti „peash“), což se rovná dekadickému logaritmu hodnoty [H+] se záporným znaménkem. Vzorec pro výpočet pH:
Název veličiny naznačuje, že kyselost nebo zásaditost média lze vyjádřit pouze koncentrací vodíkových iontů.

Výpočet hodnoty pH pro roztoky různé kyselosti
Zkusme vypočítat pH pro čistou vodu a neutrální vodné roztoky:
pH= −log[H+] = −log10 −7 = −(−7) = 7.
Pro neutrální vodné roztoky a čistou vodu je pH = 7.
Vypočítejme hodnotu pH pro roztok silné jednosytné kyseliny (například HCl) o koncentraci 1 mol/l. Koncentrace vodíkových iontů H + je rovněž 1 mol/l. Dosadíme hodnoty do iontového součinu vody, který si v tomto řešení zachová hodnotu 10 −14:
Кw = [H + ][OH − ] = [1 mol/l] × [OH − ] = 10 −14.
V tomto případě [H+] = 10 (protože 0 = 10 mol/l).
Potom pH = −log10 0 = 0.
Pro roztoky silných kyselin pH = 0.
Vypočítejme hodnotu pH pro roztok silné zásady (například KOH) o koncentraci 1 mol/l. Iontový produkt vody má formu:
Proto pH = −log10 −14 = 14.
Pro roztoky silných zásad je pH = 14.
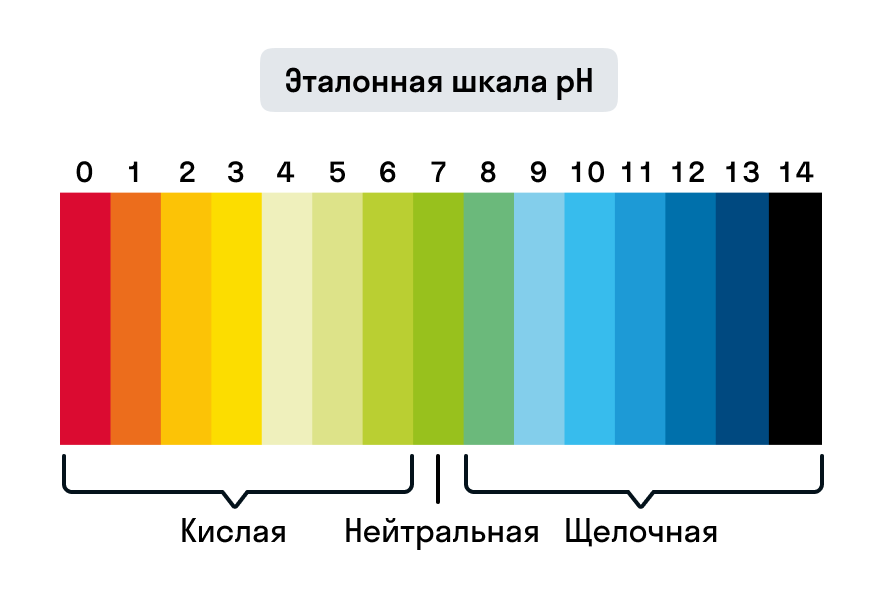
Hodnoty pH se tedy mohou pohybovat od 0 do 14. Čím nižší pH, tím kyselejší prostředí. A naopak: čím vyšší pH, tím vyšší zásaditost prostředí.
Silně kyselé vlastnosti roztoku jsou charakteristické pro pH = 0–3, silně zásadité vlastnosti pro pH = 12–14.
Hodnoty pH v závislosti na povaze média:
- v neutrálních vodných roztocích pH = 7;
- v kyselých kyselinách – pH < 7;
- v alkalickém prostředí – pH > 7.

Vodíkový indikátor v každodenním životě a výrobě
V běžném životě je za neutrální prostředí považováno rozmezí pH = 5–8,5. Roztoky takové kyselosti (nebo zásaditosti) jsou bezpečné pro lidskou pokožku a sliznice. Níže jsou uvedeny hodnoty pH některých látek, se kterými se setkáváme v každodenním životě:

Hodnota pH je důležitá v mnoha průmyslových odvětvích:
- v kosmetologii je mnoho produktů testováno na optimální hodnotu pH pro bezpečnost pokožky;
- v zemědělství se pro pěstování plodin určuje kyselost prostředí;
- v ekologii změny kyselosti dešťové vody, řek, jezer ukazují na zhoršení podmínek prostředí atd.
Teorii si snáze zapamatujete, pokud je podložená příklady z reálného života. Studenti online kurzů chemie na Skysmart se v každé lekci dozvídají něco nového o světě kolem sebe a učí se aplikovat znalosti v praxi.

Metody stanovení hodnoty pH roztoku
Povaha média (kyselé, neutrální nebo zásadité) se určuje pomocí indikátoru.
Ukazatele – látky, které mění barvu roztoku při různých hodnotách pH.
K určení povahy média stačí přidat několik kapek vodně-alkoholového roztoku indikátoru do studovaného roztoku – a barva se změní.
V praxi jsou nejčastějšími indikátory methyloranž, lakmus a fenolftalein. Barva těchto indikátorů v kyselém, neutrálním a zásaditém prostředí je uvedena v tabulce:
Stanovení pH média pomocí indikátoru je rychlá a vizuální metoda, ale pro stanovení přesnější hodnoty pH se používá univerzální indikátor.
Univerzální indikátor je směs sušených látek nanášená na papír. S jeho pomocí můžete určit povahu prostředí v širokém rozmezí pH – od 1 do 14.
Pro měření hodnoty pH se testovací roztok nanese na papírový proužek a poté se barva indikátoru porovná se standardní stupnicí.
Kromě určení povahy média můžete pomocí indikátoru sledovat změny koncentrace složky v roztoku. Například neutralizační reakce (reakce mezi kyselinou a zásadou) probíhá bez jakýchkoliv známek (srážení nebo vývin plynu). Pokud ale do kyselého roztoku přidáte lakmusový indikátor, roztok zčervená a po přidání zásady zfialoví. Změna barvy indikátoru potvrdí průběh neutralizační reakce.
Pomocí speciálního zařízení pH metr umožňuje měřit hodnoty pH v širším rozsahu a s větší přesností (až 0,01 jednotek pH) ve srovnání s indikátory.
Činnost pH metru je založena na měření elektromotorické síly (EMF), kterou vytvářejí elektrody po ponoření do roztoku.

Samotestovací otázky
- Jaké hodnoty pH jsou typické pro kyselé, neutrální a zásadité prostředí?
- V jakých oblastech vědy a výroby je nutné měřit hodnoty pH roztoku látky? Uveďte několik příkladů.
- Co je indikátor? Jak jej můžeme použít k určení povahy prostředí?
- Jaké jsou výhody univerzálního indikátoru?
- Jak se jmenuje přístroj pro přesnější stanovení pH prostředí? Dejte jeho přednosti.
pH (od lat. pondus hydrogenii – hmotnost vodíku, vyslovovaná [pah]), také nazývaná hodnota PH nebo naindex kyselosti, jde o jednu z nejdůležitějších veličin vyjadřujících acidobazické vlastnosti roztoku. pH se plynule mění v rozsahu od 0 do 14. Kyselé vlastnosti se objevují při pH < 5: čím nižší je pH, tím silnější jsou kyselé vlastnosti. Například pH citronové šťávy = 2, Coca-Coly = 4.0, mléka = 6.6. 6.9. Základní vlastnosti látek se zvyšují, když se pohybujete směrem k pravému konci stupnice pH.
Existují také prostředí s neutrálním pH. Přísně vzato, neutrální prostředí má pH = 7, ale v běžném životě je považováno za neutrální od 5 do 8.5 – to je fyziologické rozmezí, které je přijatelné pro život lidí i zvířat a je bezpečné pro pokožku a oči. Proto se pH přírodní vody obvykle pohybuje v tomto rozmezí.
Hodnota pH je ve skutečnosti kriticky důležitá nejen v kosmetologii, ale téměř v každém odvětví – od zemědělské chemie až po medicínu nebo dopravu, protože ovlivňuje průběh velkého množství chemických, biologických a ekologických procesů.
Jistě si vzpomínáte na oblíbenou reklamu na pH-neutrální šampon s pH = 5.5 před několika lety.
Pojďme zjistit, co to je pH proč je to tak důležité a odkud se berou „magická čísla“ 5.5 a 7? pH neutrální šampon a pH neutrální roztok.
Voda, kyseliny a zásady.
Pojďme k vlastnostem vody. Voda je jedinečná látka, která určuje tvář tohoto světa. Velké množství procesů, které se odehrávají na povrchu země – v každodenním životě, v dopravě, v průmyslu, v zemědělství, v přírodě – probíhá ve vodním prostředí. Zejména lidské tělo sestává v průměru ze 70 % z vody.
Voda je univerzální rozpouštědlo. Mezi látkami, které se rozpouštějí ve vodě, lze rozlišit dvě hlavní třídy:
- Kyseliny – látky, které jsou po rozpuštění ve vodě schopny uvolňovat vodíkový iont H+.
- Důvody – látky, které po rozpuštění ve vodě přijímají vodíkový iont a uvolňují záporně nabitý hydroxylový iont OH-.
Regulací koncentrace těchto iontů můžeme řídit chemické a biochemické procesy. Například v potravinářském průmyslu je to: kvašení zelí, kysání mléka, tvorba kyselého mléka, výroba vína nebo piva.
Pokud je v roztoku příliš mnoho vodíkových iontů, negativně to ovlivní
životně důležitá činnost živých organismů. Téměř všechny živé buňky jsou velmi citlivé na změny pH a i mírná oxidace je pro ně nebezpečná. Některé materiály, jako jsou kovy, nesnesou silné kyselé vlastnosti a podléhají lavinové korozi. Aby bylo možné kvantitativně charakterizovat kyselé vlastnosti média, existuje vodíkový index, také známý jako index kyselosti, také známý jako index pH.
Měření indexu vodíku.
Jelikož jsou ionty velmi malé, obsahuje i malý objem vody velké množství částic. Proto se v chemii koncentrace iontů obvykle vyjadřuje v molech na litr, kde 1 mol je „porce“ rovnající se Avogadrově číslu = 6.02 * 1023 kusů.
Koncentrace vodíkových iontů ve vodě se může měnit ve velmi širokých mezích –
od 1 mol/l do 10-14 mol/l.
Při výpočtu výsledků měření je nepohodlné pracovat s tak velkými čísly, proto byla vyvinuta speciální logaritmická stupnice neboli stupnice pH pro klasifikaci obsahu vodíkových iontů ve vodě. Jeho význam spočívá v tom, že po výpočtu dekadického logaritmu koncentrace je nutné výsledné záporné číslo vynásobit (-1).
pH = – log(C),
kde C je koncentrace vodíkových iontů H+, vyjádřená v mol/l.
















