Globální marketing poměrně často používá indikátor pH na domácích chemikáliích, kosmetice a potravinářských výrobcích jako něco pozitivního a užitečného pro lidi. V této recenzi jsme se rozhodli podívat se na tento význam a konkrétně odpovědět na otázku, co je pH, jak se měří a co ovlivňuje. Takže začneme.
Vodík (pH faktor) je hodnota aktivity vodíkových iontů v roztoku, která vyjadřuje jeho kyselost v kvantitativním ekvivalentu. Optimální hodnota kyselosti je velmi libovolná a ukazatel se také liší pro různá prostředí. Většina rostlin například preferuje mírně kyselé pěstební prostředí. Ideální úroveň kyselosti půdy pro flóru je 5.5–6.5 pH. Pokud je tento ukazatel nižší, rostliny ztrácejí možnost absorbovat složky užitečné pro růst. Proto se okamžitě shodneme, že „dobrá“ nebo „špatná“ hladina pH je subjektivní pojem.

Za normálních podmínek se hodnota pH pohybuje v rozmezí 0–14 jednotek. V čisté vodě je při neutrální hodnotě pH koncentrace kladných iontů shodná s koncentrací záporných iontů a je 1×10 -7 mol na litr. Maximální hodnota je 14. Ale někdy může kyselost přesáhnout 14 jednotek.
Můžeme říci, že pH je indikátor, který pomáhá identifikovat počet vodíkových iontů v látce, aby bylo možné odpovědět na to, jaké složení je v ní vlastní – alkalické nebo kyselé.
Stupnici potenciálu vodíkových iontů vytvořil dánský biochemik Soren Peter Lauritz již v roce 1901, když prováděl výzkum aminokyselin, enzymů a proteinů. Protože koncentrace vodíku ovlivnila fermentaci, bylo nutné vytvořit způsob, jak ji vypočítat. Soren vytvořil stupnici od 1 do 14, kde hodnota od 1 do 6 znamená, že prostředí je kyselejší, a úroveň od 8 do 14 signalizuje zásaditý charakter látky.
Hladiny pH v každodenním životě
Moderní lidé konzumují mnoho chemických produktů, takže stanovení pH se stalo velmi důležitým pro lékařské účely. Je známým faktem, že hladina pH žaludku se pohybuje v rozmezí od 1 do 4. Hodnoty jsou vysoké, ale tak to má být, protože člověk ke trávení potravy potřebuje kyselinu. Některé produkty vyvolávají produkci vyšší koncentrace kyseliny, jiné naopak tento proces potlačují. Neustálý přebytek kyseliny může vést ke vzniku vředů a dalších onemocnění.
Zvýšené hodnoty pH způsobují destrukci zubní skloviny. Bezprostředně po čištění je hladina vodíkových iontů 7 – to je neutrální indikátor, který nepoškozuje zuby. Následně se kyselost změní o 5–5,5 jednotek. V ústech se objevuje kyselá chuť. Narušuje se acidobazická rovnováha, o které se tolik mluvilo v reklamě jedné slavné žvýkačky.
Kyselost půdy: metody, vlastnosti
Nejpřesnějším přístrojem pro měření kyselosti půdy je pH metr. Tato úroveň je způsobena:
- historický typ vegetace;
- klima;
- zdrojový materiál;
- stáří půdy.
Jaký vliv má úroveň kyselosti na komerční rostliny? Především zajišťuje dostupnost živin, mikroprvků a fosforu. Pokud jsou půdy kyselé, výnosy se snižují, bakterie vázající dusík jsou zakrnělé a herbicidy zpomalují rozklad. Hliník se navíc mění v toxin, který extrémně negativně ovlivňuje fyziologické procesy z hlediska vývoje kořenového systému.
Mluvili jsme o kyselosti půdy, ale vysoká zásaditost škodí i rostlinám. Snižuje se produktivita a zvyšuje se riziko popálení při dlouhodobém kontaktu kořenů s močovinou. Pokud je tedy vaším oborem zemědělství, určitě si pH metr pořiďte.
Všechny metody pro stanovení úrovně kyselosti látek
Pro stanovení kyselosti bylo zavedeno několik metod. Koncentraci vodíku lze hodnotit pomocí indikátorů, měřit pH metrem nebo určit pomocí analytiky.
Acidobazické indikátory
Vhodné pro přibližný odhad množství vodíkových iontů. Jako indikátory se používají barviva, jejichž barva se mění v závislosti na prostředí. Nejběžnější jsou:
- lakmusové proužky;
- fenolftaleinové indikátory;
- methylová oranž
Proužky na stanovení pH, známé všem ze školy, obsahují lakmus, který mění barvu v rozmezí 1–2 jednotek.
Univerzální
Za účelem rozšíření rozsahu měření se obracejí na univerzální prostředky. Technicky jde o kombinaci několika ukazatelů. Tyto indikátory postupně mění barvu nejprve na žlutou, poté červenou a poté na zelenou a modrou. Poslední odstín je fialový.
Papírové proužky jsou napuštěny roztoky univerzálních indikátorů, pomocí kterých se zjišťuje hladina kyselosti na desetiny pH.
pH metr
Speciální zařízení, které umožňuje měřit hladinu vodíku v jakémkoli prostředí s minimální chybou a citlivostí 0,01 jednotky. Pomocí přístroje je vhodné analyzovat vodu a neprůhledné roztoky.
Analytická metoda (objemová)
Tato metoda také umožňuje získat přesné výsledky. Funguje to takto. K testovanému roztoku se přidá několik kapek koncentrovaného titračního činidla. Když se komponenty spojí, spustí se chemická reakce. Během reakce je dosaženo ekvivalence vrcholu – okamžik, kdy je dostatek titračního činidla k dokončení reakce. Tento okamžik zaznamenává indikátor. Při znalosti koncentrace a objemu přidaného titračního činidla se vypočítá kyselost média.
Vliv teploty na kyselost
Index kyselosti se mění v poměrně širokém rozmezí, pokud dochází ke kolísání teploty. Například 0,001 molární roztok NaOH při teplotě 20 °C má kyselost pH = 11,73 a při zahřátí na 30 °C se tento indikátor změní na pH = 10,83. Teplotní efekt je způsoben rozdílnou disociací vodíkových iontů.
Na závěr naší recenze zdůrazněme, že úroveň kyselosti se dnes neměří pouze v půdě, vodě nebo žaludku. Dále se analyzují následující média: moč, krev, kůže, ocet, mléko, sliny.
Mít možnost měřit vodík v lékařství, potravinářském průmyslu, výrobě krmiv a hnojiv pro zemědělské rostliny je běžnou praxí, na kterou přechod bude stát nemalé peníze.
VÝROBCE
specializovaná chemie
Stupnice pH se používá k určení stupně kyselosti nebo zásaditosti roztoku na kvantitativní stupnici obsahující absolutní čísla od 0 do 14. Je založena na molární aktivitě hydroniových iontů (také nazývaných hydroniové ionty) [H3O + ] ve zkušební kapalině. Stupnici vyvinul v roce 1909 dánský biochemik S. Sorensen a písmena „p“ a „H“ přítomná v názvu zase znamenají latinské slovo „potentio“ – síla, stejně jako atom vodíku, psaný v periodické tabulce jako H (hydrogenium ), resp. Stupnice pH odráží první i druhou – pro určení reakce se používá exponent s opačným znaménkem a referenčním bodem jsou protony obsahující vodík. Reakce každého výsledného roztoku je důležitou chemickou charakteristikou tohoto roztoku a faktorem, který určuje průběh a rychlost mnoha chemických reakcí a také typ produktů v nich vznikajících.

Rozdíl v měřítku
Stupnice pH má patnáct stupňů, přičemž průměr 7 znamená neutrální. Roztoky umístěné blízko 0 se nazývají silné kyseliny a roztoky umístěné na opačné straně, blízko 14, se nazývají silné zásady. Kyselá reakce ukazuje na přebytek vodíkových iontů [H3O + ] v roztoku ukazuje alkalická reakce přebytek hydroxylových iontů [OH – ]. Nejčastěji se v souvislosti s roztoky zmiňuje stupnice pH, ale absolutní chemický potenciál protonu ji umožňuje aplikovat na všechna skupenství hmoty. Umožňuje tedy přímé srovnání úrovně alkality téměř jakékoli látky.
Autodisociace vody
Abychom plně pochopili význam pH stupnice, je nutné provést spontánní autodisociační reakci vody podle rovnice:

Jedná se o vratný proces, jehož rovnovážná konstanta je posunuta na levou stranu rovnice, tedy směrem k nedisociované vodě.
Jak vypočítat pH reakci?
Navzdory původně nesprávnému předpokladu, že se určuje koncentrace vodíkových iontů [H + ], stále se nejčastěji používá rovnice:

Nyní je však známo, že roztoky vůbec neobsahují volné vodíkové ionty, tj. protony přítomné ve vzorci, díky procesu okamžité solvatace. Tento jev má za následek nepřítomnost volných protonů ve prospěch přítomnosti hydroniových iontů [H3O + ] v důsledku spontánní, nevratné reakce:
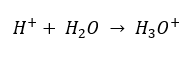
Správný vzorec je tedy následující:
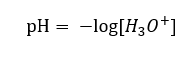
Médium zobrazené na stupnici pH
Předpokládá se, že koncentrace hydroniových iontů v čisté vodě při pokojové teplotě 25 o C je 10 -7 mol/dm 3, a proto lze jeho reakci vypočítat na stupnici pH jako:
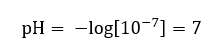
To je v souladu se skutečností, že voda, protože je neutrální, je uprostřed stupnice, což naznačuje, že látka reaguje neutrálně. To také znamená, že ve vodě jsou stejná množství hydroxylových aniontů a hydroniových kationtů. U kyselin a zásad je však tato rovnováha narušena. Exponent se znaménkem mínus naznačuje závislost, že čím nižší je hodnota pH, tím větší je síla zkoumaného roztoku. Výraz „síla“ v případě stupnice pH znamená, že hodnotu 0 mají silné, dokonce i žíravé kyseliny, a hodnota 14 označuje nejsilnější alkalické reakce.
Přidání kyseliny do vody
Změna pH z neutrálního může být způsobena přidáním látek různé síly. Například přidání jedné z nejsilnějších kyselin, kyseliny chlorovodíkové HCl, do vody způsobí její disociaci podle reakce:

Rovnováha kyselé disociační reakce je na rozdíl od autodisociace vody silně posunuta na pravou stranu produktů. To vede k tomu, že rozpouštění této kyseliny v neutrální vodě zvyšuje počet hydroniových iontů v ní přítomných a tím zvyšuje jejich molární aktivitu. Například kyselina chlorovodíková o objemu 1 mol/dm 3 podle disociační reakce vnáší do roztoku hydroniové ionty o koncentraci 1 mol/dm 3. pH pro takový roztok kyseliny chlorovodíkové lze vypočítat pomocí vzorce:
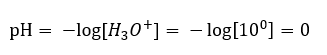
Přidání báze do vody
V případě opačné situace – přidání silné zásady do vody se koncentrace hydroniových iontů sníží. Například hydroxid sodný o koncentraci 1 mol/dm3 bude mít stejnou koncentraci, ale různé ionty – hydroxyl, v souladu s reakcí, kterou podstoupí při kontaktu s vodou:

V tomto případě lze pH vypočítat nepřímo pomocí dalšího vzorce pro pOH:
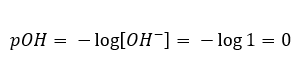
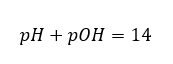
Je snadné spočítat, že pH roztoku silné zásady NaOH o koncentraci 1 mol/dm3 má hodnotu pH 14.

Je reakce pH mimo stupnici?
Vzhledem k tomu, že stupnice pH byla původně vytvořena pro zředěné roztoky, mohou silné kyseliny nebo zásady klesnout mimo její limity, tj. pod 0 nebo nad 14. Je to proto, že stupnice není vhodná pro vysoké koncentrace, kde reakce již není logaritmickou funkcí koncentrace hydroniové ionty [H3O+]. V tomto případě se používají jiné hodnoty, které se získají z rovnovážných konstant autodisociace kyselin a zásad.
Metody stanovení pH roztoku
K empirickému stanovení reakce prostředí se používají tzv. alkacymetrické indikátory. V praxi se jedná o látky, které mění barvu za různých podmínek pH. Existují tři typy takových indikátorů:
- Například ty, které mění barvu v alkalickém prostředí:
- bezbarvý fenolftalein mění barvu na karmínovou,
- bezbarvý thymolftalein mění barvu na modrou.
- Změna barvy v kyselém prostředí, například:
- methyloranž mění barvu z oranžové na červenou,
- Bromfenolová modř mění barvu z modré na žlutou.
- Univerzální indikátory, např.
- Bromthymolová modř se v kyselinách mění na žlutou a v zásadách na modrou.
- Lakmus se barví v kyselinách do červena a v zásadách do modra.
Běžnou praxí je také namáčení lakmusového papírku do směsi různých indikátorových látek, čímž se rozsah pH v seznamu rozšíří. Kromě toho se v laboratořích často používají hotové univerzální indikátorové papírky, které jsou zbarveny například od červené po zelenou, a to předpokládá odpovídající testované pH na základě stupnice k nim připojené. Tato indikace umožňuje odhadnout hodnotu pH pouze s přesností 0,5 jednotky na stupnici pH.
Přesnější metodou měření pH reakce je alkalimetrická titrace, která se dělí na alkalimetrii (titrace standardním alkalickým roztokem) a acidimetrii (titrace standardním kyselým roztokem). K tomu se používá titrační činidlo o známé koncentraci, které reakcí se zkoušenou látkou mění koncentraci hydroniových iontů přítomných v roztoku. Toto stanovení lze provést dvěma způsoby – konečný bod se určí vizuálně změnou barvy nebo pomocí instrumentálních metod, například potenciometricky nebo konduktometricky.
Použití pH metru, jak název napovídá, také umožňuje určit reakci látky. Zařízení, pracující na principech potenciometrie, má článek se dvěma stejnými elektrodami. Jedna z nich, nazývaná indikační elektroda, musí být umístěna v testovaném roztoku. Další elektroda, která je referenční elektrodou, se umístí do standardního roztoku se známým pH. Často se používá roztok chloridu stříbrného. Tyto elektrody jsou napojeny na velmi citlivý voltmetr, který za chodu převádí EMF, měření elektromotorické síly, na konkrétní výsledek na stupnici pH. Podle Nernstovy teorie je elektromotorická síla článku (EMF), sestávajícího ze dvou stejných elektrod ponořených do roztoků, které se liší z hlediska reakcí, přímo úměrná logaritmu koeficientu těchto koncentrací.
Domácí metody měření pH
Ukazuje se, že existuje mnoho přirozených indikátorů pH a přibližnou hodnotu pH si můžete změřit doma. Například nálev z lístků černého čaje se zesvětlí, když se přidá kyselina, jako je citronová šťáva. Na druhou stranu tento nálev ztmavne vlivem alkálií, například roztoku jedlé sody. Šťáva z červeného zelí se v přítomnosti kyseliny změní z fialové na červenou a po přidání alkálie zmodrá.
- Rozdíl v měřítku
- Autodisociace vody
- Jak vypočítat pH reakci?
- Médium zobrazené na stupnici pH
- Přidání kyseliny do vody
- Přidání báze do vody
- Je reakce pH mimo stupnici?
- Metody stanovení pH roztoku
- Domácí metody měření pH














