Síra — chemický prvek č. (16). Nachází se ve skupině VI A třetího období periodické tabulky.
S 16 + 16 ) 2 e ) 8 e ) 6 e
Vnější vrstva atomu síry obsahuje šest valenčních elektronů. Před dokončením vnější vrstvy chybí dva elektrony. Proto ve sloučeninách s kovy a vodíkem vykazuje síra oxidační stav (–2). Při interakci s více elektronegativními prvky (kyslík, halogeny) tvoří síra sloučeniny, ve kterých je její oxidační stav kladný ((+4) nebo (+6)).
V zemské kůře se síra nachází v přirozené formě nebo ve formě minerálů a hornin: (pyrit – Fe S 2, zinková směs – ZnS, lesk olova – PbS, sádrovec – CaS O 4 ⋅ 2 H 2 O, Glauberova sůl – Na2S4⋅ 10H2).


Rýže. (1). Nativní síra
Rýže. (2). Pyrit
Síra je jedním z makroprvků živých organismů. Nachází se v bílkovinách. Nejvíce síry se nachází v bílkovinách, které tvoří vlnu, vlasy a rohy. Je také součástí některých vitamínů a hormonů.
Síra tvoří několik alotropních modifikací. Obvykle se zabýváme krystalickou sírou, která se skládá z osmiatomových cyklických molekul.

Rýže. (3). Model molekuly síry
Molekuly tvoří krystaly různých struktur, a proto existují alotropní modifikace: kosočtverec и monoklinika síra. Obě modifikace jsou žluté, tavitelné látky. Jejich teploty tání se mírně liší ((+112,8) °C a (+119,3) °C).

Při zahřátí se síra roztaví, změní se na světlou kapalinu a poté začne tmavnout a stát se viskózní. Zformováno plastický síry, skládající se z dlouhých lineárních molekul.
Síra se ve vodě nerozpouští a není jí smáčena. Proto sírový prášek neklesá ve vodě, i přes jeho vyšší hustotu ((2,07) g/cm³). Tento jev se nazývá flotace.
Zapálená síra reaguje s kyslíkem za vzniku oxidu siřičitého. Síra v této reakci – redukční činidlo .
S 0 + O 2 0 = t S + 4 O 2 − 2 .
Oxidační vlastnosti síra se projevuje reakcemi s kovy a vodíkem.
Reaguje s aktivními kovy a rtutí při pokojové teplotě:
Hg 0 + S 0 = Hg + 2 S − 2 .
Síra při zahřívání reaguje s většinou kovů – železem, hliníkem, zinkem a dalšími, kromě zlata a platiny.
2 Al 0 + 3 S 0 = t Al + 3 2 S − 2 3 .
Při reakcích s kovy vznikají sulfidy.
Při zvýšených teplotách síra reaguje s vodíkem. Zformováno sirovodík:
H2 + S0 = tH0 + 2 S -1.
Aplikace síry
- Používá se v chemickém průmyslu k výrobě kyseliny sírové;
- používá se v zemědělství k dezinfekci prostor;
- obsažené v některých mastech;
- používané při výrobě zápalek a papíru;
- s jeho pomocí se pryž přemění na pryž;
- je součástí výbušnin.
V rostlinách jsou dusík a síra důležitými stavebními kameny bílkovin. Nedostatek síry výrazně snižuje efektivní využití dusíku a omezuje syntézu bílkovin. Od industrializace pochází velká část síry v půdě z oxidu siřičitého, který se nachází ve znečištěném vzduchu (kvůli spalování fosilních paliv). Snížené emise snižují tento zdroj síry v atmosféře, takže vyvážené hnojení je ještě důležitější.
Síra může být rostlinami absorbována pouze z půdního roztoku ve formě síranu. Stejně jako u snadno dostupných dusičnanů může dojít k jejich ztrátě vyluhováním. Proto se doporučuje aplikovat síranová hnojiva na jaře, aby je rostlina v období aktivního růstu mohla vstřebat, jako je tomu u dusičnanů. Síra je potřebná spolu s dusíkem pro tvorbu bílkovin a doba vstřebávání je stejná.

elementární síra
Na rozdíl od síranového hnojiva, které je okamžitě připraveno k absorpci, musí být elementární síra přeměněna na síran činností bakterií žijících v půdě, než je k dispozici rostlině. Trvání tohoto oxidačního procesu je nepředvídatelné a může trvat několik měsíců: kvůli tomu nemusí být sulfát potřebný pro rostlinu k dispozici přesně v době, kdy je nejvíce potřeba.
Proteosyntéza
Síra je nezbytná pro mnoho funkcí růstu rostlin – stejně jako dusík je důležitou složkou bílkovin. V důsledku toho existuje úzký vztah mezi množstvím dusíku a síry v plodinách, přičemž většina z nich spotřebuje asi 1 kg síry (2,5 kg SO3) na každých 12 kg dusíku.

Vstřebávání SO3 PŠENOU, BRAMBOREM A ZELÍ V OBDOBÍ ROSTOU
Brassica plodiny, jako je řepka olejka, zelí a brukev vyžadují mnohem vyšší množství síranu. Vyžadují další síru k produkci glukosinolátů, které se v rostlinách používají jako obranný mechanismus.
Po vstřebání se síra na rozdíl od dusíku nepohybuje proti transpiračnímu proudu a nelze ji odebírat například ze starých listů pro podporu nového růstu. K uspokojení všech potřeb pěstování plodin je tedy nutný dostatečný a nepřetržitý přísun půdy do půdy.

Mezi příznaky nedostatku patří žloutnutí mladých listů nebo nových výrůstků. Naproti tomu žloutnutí v důsledku nedostatku dusíku postihuje především starší listy.
Řepka olejka s nedostatkem síry může mít fialové a miskovité vzcházející mladé listy, pomalé a dlouhé kvetení, světlé květy a méně menších lusků.
Riziko nedostatku síry se může zvýšit v zemích, kde hladiny síry v atmosféře – důsledek znečištění ovzduší spalováním fosilních paliv – klesají. V USA a EU emise oxidu siřičitého prudce klesly. Podle Observatoř Země (který využívá data z výzkumu NASA), dokonce i Asie, oblast světa, která produkuje nejvíce oxidu siřičitého, zaznamenává pokles atmosférické síry. Emise oxidu siřičitého v Číně prokázaly stálý pokles znečištění ovzduší během dvou období během prvních dvou desetiletí tohoto století, což stejně jako v jiných postindustriálních oblastech světa povede k tomu, že se do půdy dostane méně síry.
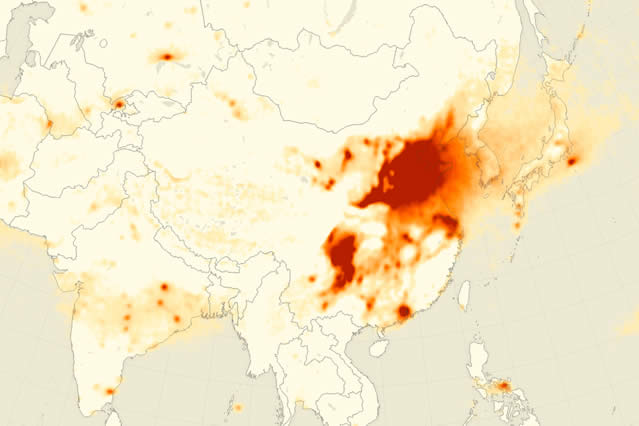
DLOUHODOBÉ PRŮMĚRNÉ KONCENTRACE OXIDU SIRIČITÉHO MĚŘENÉ OMI ZA ROK 2005–2007.
Zdroj: NASA Earth Observatory

DLOUHODOBÉ PRŮMĚRNÉ KONCENTRACE OXIDU SIRIČITÉHO MĚŘENÉ OMI ZA ROK 2011–2014.
Zdroj: NASA Earth Observatory
















