Titrimetrické metody kvantitativní analýzy jsou založeny na přesném měření objemu roztoku činidla (titrantu), který vstupuje do chemické reakce s testovanou látkou. V této lekci se podíváme na titrační algoritmus krok za krokem.
Pro úspěšné zvládnutí materiálu doporučujeme prostudovat následující pojmy:
Objem roztoku přesně změřený kalibrovanou pipetou
Odměrná skleněná trubice s aretací na spodním konci – kohoutek, kde se častěji používá v permanganatometrii, nebo s korálkem – Mohrova svorka
Koncový bod titrace
Bod titrace, ve kterém změna ve vlastnosti systému ukazuje, že bylo dosaženo ekvivalence
Erlenmeyerova kónická baňka
Používá se pro titraci s indikátorem. K dispozici v různých kapacitách, s dělením a bez dělení, s úzkým hrdlem a širokým hrdlem, s nebo bez broušení
Titrační metoda, při které se k analytu přidá přebytek titračního činidla-1 a tento přebytek se titruje titrantem-2
Látka, která má být určena
Chemický prvek, jednoduchá nebo složená látka, jejíž obsah je stanoven ve vzorku
Přímá titrace
Titrační metoda, při které se titrační činidlo přidává přímo k analytu
Titrimetrické metody kvantitativní analýzy
Na základě přesného měření objemu roztoku činidla (titrantu), který vstupuje do chemické reakce se zkoušenou látkou
Roztok, který má přesnou koncentraci a interaguje s analytem
Bod ekvivalence (PE)
Bod titrace, ve kterém se množství přidaného titračního činidla chemicky rovná množství analytu
Titrační metoda, při které se do reakce přidá pomocné činidlo za vzniku produktu, který se pak titruje
Acidobazická titrační metoda
Na základě použití neutralizační reakce. Slouží ke stanovení kyselin, zásad a solí, které při hydrolýze vytvářejí kyselou a alkalickou reakci prostředí
Srážecí titrační metoda
Ve kterých zkoušená látka při interakci s titračem tvoří špatně rozpustné sloučeniny
Metoda komplexometrické titrace
Na základě tvorby slabě ionizovaných komplexů titračního činidla s testovanou látkou
Redoxní titrační metoda
Na základě redoxních reakcí probíhajících mezi analytem a titrantem
Video přednáška
Základní pojmy
Titrant – roztok, který má přesnou koncentraci a interaguje se stanovovanou látkou.
Látka, která má být určena — chemický prvek, jednoduchá nebo složená látka, jejíž obsah je stanoven ve vzorku.
Bod ekvivalence – bod titrace, ve kterém se množství přidaného titračního činidla chemicky rovná množství stanovované látky.
Koncový bod titrace – okamžik titrace, kdy změna vlastnosti systému indikuje dosažení ekvivalence.
Klasifikace titrimetrických metod analýzy podle typů chemických reakcí
- Na základě použití neutralizační reakce
- Slouží ke stanovení kyselin, zásad a solí, které při hydrolýze vytvářejí kyselou a alkalickou reakci prostředí
- V kombinaci s různými metodami přípravy vzorků jej lze použít ke stanovení různých parametrů
- Zkoušená látka při interakci s titračním činidlem tvoří špatně rozpustné sloučeniny
- Hojně používanou metodou srážecí titrace je argentometrická titrace, při které se zjišťuje koncentrace aniontů, které tvoří špatně rozpustné sloučeniny nebo stabilní komplexy s ionty stříbra.
- Na základě tvorby slabě ionizovaných komplexů titračního činidla s testovanou látkou
- Komplexometrická titrace – titrace Trilonem. Koncový bod titrace se stanoví pomocí kovových indikátorů nebo potenciometricky
- Na základě redoxních reakcí probíhajících mezi analytem a titrantem
- Existují dva běžné typy: permanganatometrie a dichromatometrie.
Klasifikace titračních metod podle titrační metody
1. Přímá titrace – titrace, při které se titrační činidlo přidává přímo ke stanovované látce.
2. Zpětná titrace – titrace, při které se k analytu přidá přebytek titračního činidla-1 a tento přebytek se titruje titračním činidlem-2.
3. Titrace substitucí – titrace, při které se k reakci přidá pomocné činidlo za vzniku produktu, který se pak titruje.

Automatizace analytických technik zlepšuje přesnost měření, opakovatelnost a reprodukovatelnost výsledků. Jakmile jednou nakonfigurujete požadovanou metodu, nemusíte se obávat vlivu lidského faktoru na výsledek měření. To je zvláště užitečné pro podniky, které praktikují rotační systém, kdy má několik zaměstnanců přístup k jedné instalaci.
Standardní sada pro potenciometrickou titraci založená na zařízení GT-3100 (společný vývoj Mitsubishi Chemical Analytech Co., Ltd. a Nittoseiko Analytech, Japonsko) obsahuje:
- základní jednotka pro titraci (automatický titrátor);
- byreta, pomocí které se reguluje objem přiváděného roztoku;
- magnetické míchadlo s regulací míchání;
- elektrodový systém pro acidobazickou titraci.
Vhodné elektrody pro potenciometrický titrátor GT-310
Volba elektrod závisí na rozpustnosti analytu ve vodě.
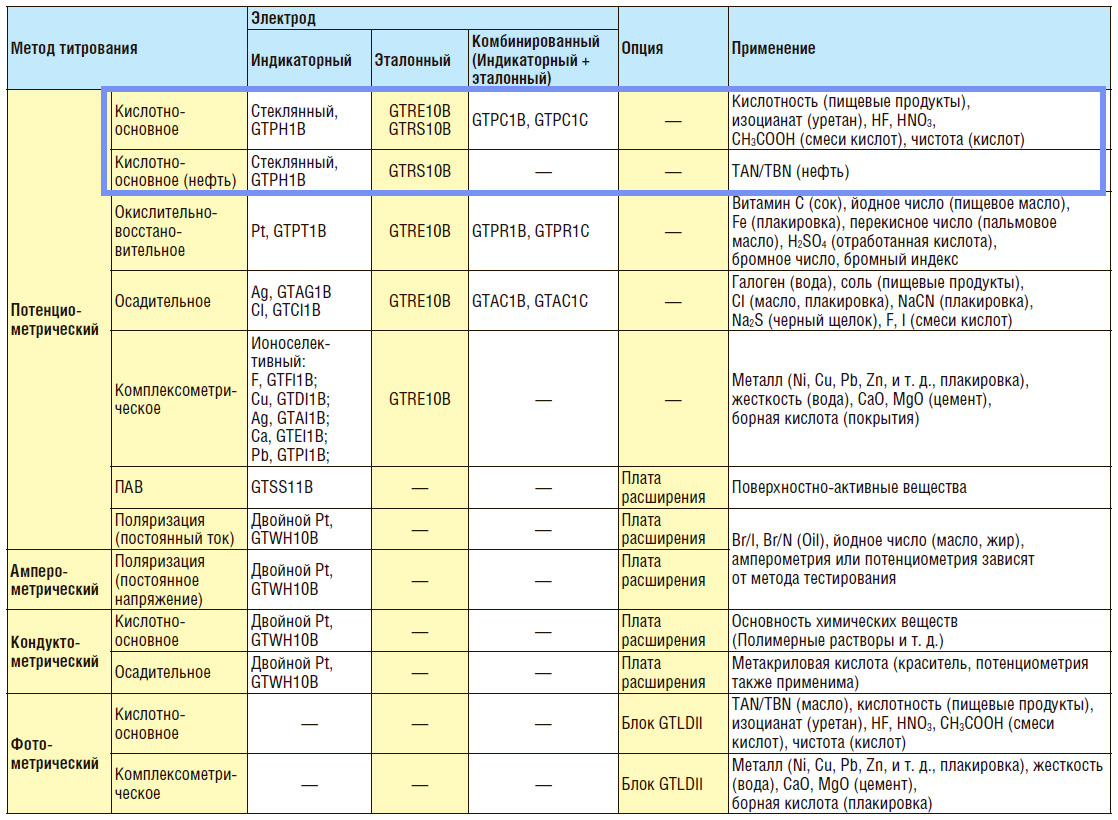
Pro vodnou titraci souprava sestávající z samostatný pár elektrod.
- měřicí skleněná pH elektroda GTPH1B;
- referenční elektroda pro vodná média GTRE10B.
Stejný systém elektrod, umístěný ve společném pouzdře, se nazývá kombinovaná elektroda. Společnost Mitsubishi Chemical Analytech nabízí dvě verze kombinovaných elektrod pro titraci vodných médií:
- standardní velikost GTPC1B;
- s úzkým hrdlem pro malé nádoby GTPC1C.
Acidobazická titrace nevodných médií je zvláště vhodná pro provádění na automatickém zařízení, protože eliminuje potřebu, aby laboratorní technik přišel do kontaktu s kyselinou octovou použitou pro analýzu.
Nevodný titrační systém zahrnuje:
• měřicí skleněná pH elektroda GTPH1B;
• referenční elektroda pro vodná i nevodná média GTRS10B.
To je přesně sada popsaná v GOST 11362-96 (určující neutralizační číslo v olejích a ropných produktech).
Dodatečně lze přístroj vybavit váhou s automatickým přenosem hmotnosti vzorku do přístroje, tiskárnou a přídavnými konektory pro připojení dalších typů senzorů.
Podstata acidobazické titrace
Acidobazická titrace je metoda volumetrické titrační analýzy založená na neutralizační reakci, umožňující stanovení koncentrací kyselin nebo zásad ve vodném i nevodném prostředí.
Podstata acidobazické titrace spočívá v přenosu protonu buď z titračního činidla na analyt, nebo naopak z analytu na titrační činidlo. Během procesu analýzy je nutné přesně určit, kdy bude množství přidané složky EKVIVALENT množství měřené složky. Tento okamžik se nazývá BOD EKVIVALENCE (TE). V případě titrace CO bude bod ekvivalence dosažen při přesně definované hodnotě pH, proto se k jejímu stanovení používají indikátory. Při přidávání kyseliny/zásady se ihned po průchodu TE objeví/zmizí volné protony v roztoku a indikátor změní barvu roztoku. Potenciometricky lze také sledovat změny pH média. V tomto případě je při dosažení TE zaznamenán potenciální skok.
Při stanovení obsahu kyselin se jako titrační činidlo používají roztoky KOH, NaOH nebo Ba(OH).2 známá koncentrace. Stanovení koncentrace zásady se provádí roztoky silných kyselin: HCl nebo H2SO4.
Před zahájením analýzy je nutné určit přesnou koncentraci titračního činidla.
Standardizace kyselin se provádí pomocí sody (Na2CO3) nebo borax (Na2B4O7* 10H2Ó).
Alkálie jsou standardizovány hydroftalátem draselným.
Dalším způsobem přípravy titračního činidla s přesně známou koncentrací je použití fixanalu.
Při práci s alkáliemi by neměly přijít do styku se vzduchem, protože oxid uhličitý v nich obsažený je snadno absorbován titrantem, což způsobuje změnu jeho koncentrace. Je také nemožné skladovat alkálie ve skle po dlouhou dobu, protože s ním interagují.
Acidobazické titrační křivky
Titrační křivka CO je vynesena v souřadnicích: pH roztoku – objem přidaného titračního činidla.
Křivka obvykle ukazuje dva inflexní body (IP), mezi kterými je bod ekvivalence.
Vzdálenost ΔpH mezi inflexními body se nazývá titrační skok. Jeho hodnota závisí na koncentracích činidel. Čím vyšší je koncentrace titračního činidla, tím větší je skok způsobený změnou kyselosti roztoku v oblasti TE. Tento skok způsobí prudkou změnu barvy indikátoru.
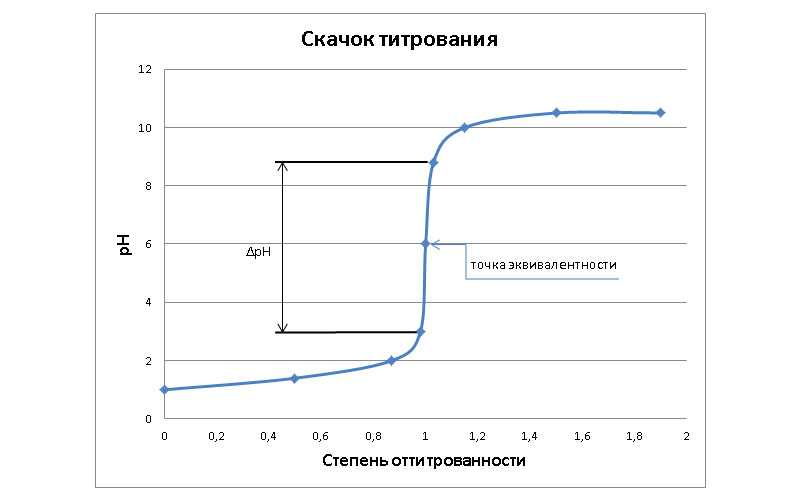
Tvar acidobazických titračních křivek bude záviset na povaze reagujícího acidobazického páru.
Lze zvážit následující klasifikaci titračních křivek:
- silná kyselina – silná zásada
- slabá kyselina – silná zásada
- silná kyselina – slabá zásada
- slabá kyselina – slabá zásada
Všechny se budou lišit velikostí titračního skoku a umístěním bodu ekvivalence.
Při titraci vícesytných kyselin dochází k jejich disociaci v krocích, takže na titrační křivce bude několik inflexních bodů. TP mohou spadat do různých rozsahů pH; v takových případech jsou k jejich identifikaci zapotřebí indikátory s různými provozními rozsahy.
Směsi kyselin (zásad) budou charakterizovány ještě složitějšími křivkami. Inflexní body se na nich mohou překrývat, což ztěžuje přesnou identifikaci palivových článků ruční analýzou.
Indikátory pro acidobazickou titraci
Všechny indikátory pracují v určitém rozmezí pH, které musí alespoň částečně spadat do rozsahu skoku titrace.
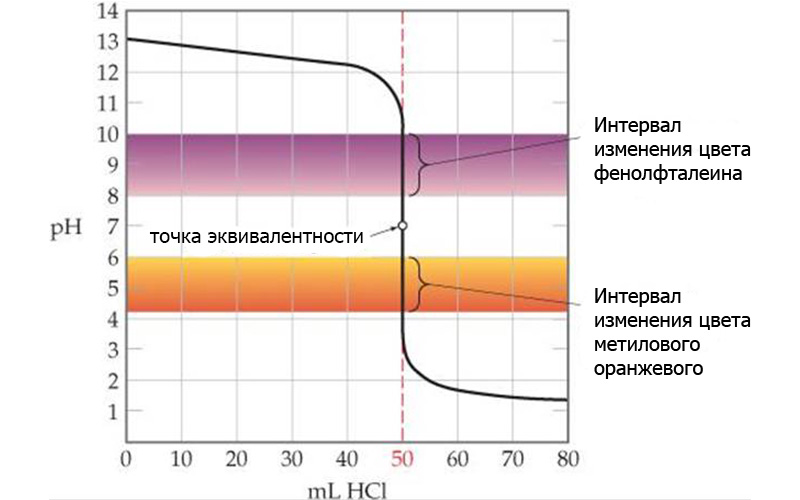
Například fenolftalein mění barvu v rozmezí pH=8-10, zatímco ke změně barvy methyloranže dochází při pH=4-6. To znamená, že indikátory nereagují na dosažení bodu ekvivalence, ale na roztok pH – a to je třeba vzít v úvahu při výběru indikátoru.
Proto jsou elektrochemické metody analýzy univerzálnější. Potenciometrický titrátor vynese kompletní titrační křivku a automaticky vypočítá bod ekvivalence na základě potenciálního skoku.
Aplikace acidobazické titrace
Potenciometrická metoda acidobazické titrace se rozšířila pro stanovení čísel kyselosti a zásad v ropných produktech. Lékopis také uvádí metody pro titraci CO bez vody. V chemickém průmyslu se ke kontrole koncentrací kyselin a zásad používá analýza ve vodných médiích.















