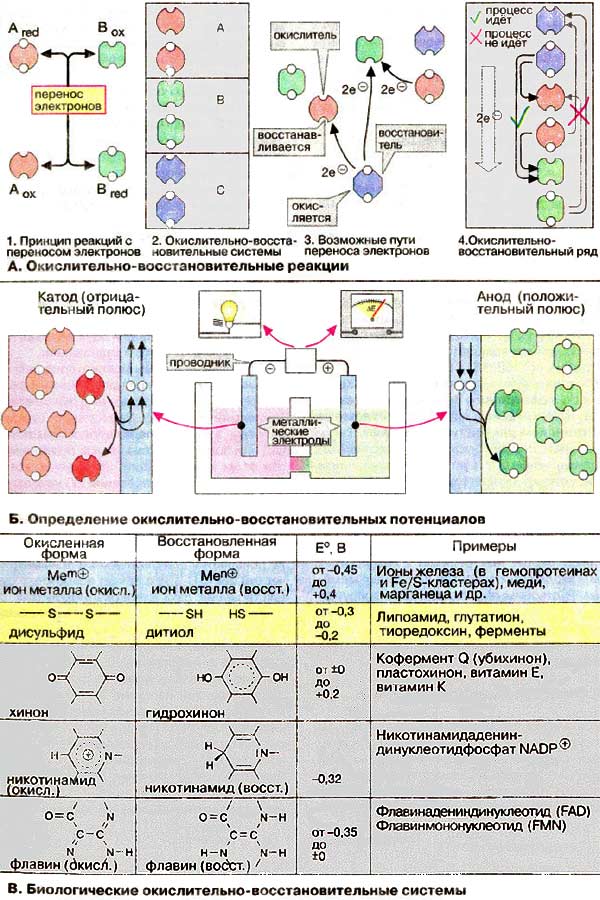
Redoxní reakce (viz str. 24) (neboli redoxní reakce) jsou reakce doprovázené přenosem elektronů z donoru na akceptor (1). Analogicky k acidobazickým reakcím (viz str. 36) tvoří interagující látky konjugované páry, které se obvykle nazývají redoxní páry (redoxní páry z angličtiny, Redoxpara, Redoxsystem, 2). Obě složky redoxního páru se liší počtem elektronů. Složka bohatá na elektrony se nazývá redukovaná forma a složka chudá na elektrony se nazývá oxidovaná forma odpovídající sloučeniny. Během redoxní reakce přenáší redukovaná forma jednoho redoxního páru (redukční činidlo) elektrony na oxidovanou formu (oxidační činidlo) druhého páru. V tomto případě je redukční činidlo oxidováno a oxidační činidlo je redukováno (3). Jakékoli redukční činidlo je účinné pouze v určitých reakcích. Na základě takových pozorování lze sestavit redoxní řadu (4).
B. Stanovení redoxních potenciálů
Poloha redoxního páru v řadě je určena redoxním potenciálem. Ten je určen (viz str. 24) pomocí elektrochemického článku, který umožňuje vyhodnotit přenos elektronů mezi dvěma redoxními páry umístěnými v různých nádobách. K průchodu elektrického proudu v důsledku přenosu elektronů mezi dvěma chemickými částicemi umístěnými v různých nádobách dochází vodičem, tj. chemická energie se přeměňuje na energii elektrickou.
V obvodu je zabudován vysokoodporový voltmetr eliminující průchod elektrického proudu. Neměří se proud, ale elektrické napětí, které odpovídá rozdílu elektrického potenciálu ΔE obou řešení. Redukční potenciál systému je definován jako emf. ve voltech (V), měřeno proti známému potenciálu vznikajícímu ve standardním půlčlánku (půlčlánku). Redukční potenciál systému 2H + /H 2 („vodíková elektroda“) je přijat jako standard, který je za určitých podmínek běžně považován za rovný nule. Potenciál konkrétního redoxního páru měřený vzhledem ke standardu může mít znaménko plus nebo mínus. Hodnota E závisí na koncentraci činidel a reakčních podmínkách. Proto se zavádí koncept standardního redox potenciálu (nebo redukčního potenciálu E o , protože charakterizuje redukční reakci), který je definován jako redukční potenciál daného redoxního páru za standardních podmínek a při stejných koncentracích všech činidel. jako E o ‘, definované jako E o při pH 7. Pokud jsou dvojice uspořádány ve vzrůstajícím pořadí jejich redukčních potenciálů, získáme elektrochemickou řadu napětí (4). Spontánní přenos elektronů je možný pouze tehdy, je-li redukční potenciál látky, která musí elektrony darovat, stejný. – hodnota, která je zápornější ve srovnání s potenciálem látky, která by měla přijímat elektrony (viz str. 24).
B. Biologické redoxní páry
Diagram ukazuje redoxní reakce, které se nejčastěji vyskytují v biologických systémech. Standardní redukční potenciály (B) odpovídajících redoxních párů se pohybují od -0,45 do +0,4 V. Ve skutečnosti závisí potenciály na prostředí proteinu.
Mnoho redoxních reakcí je katalyzováno enzymy obsahujícími kovové ionty v aktivním místě. Protože jsou takové kovy potřeba v malých množstvích, řadí se mezi tzv. stopové prvky (viz str. 10, 350). Kovové ionty tvoří komplexy s postranními funkčními skupinami aminokyselinových zbytků nebo jsou součástí kofaktorů (prostetických skupin). Ionty železa (Fe) jsou tedy přítomny v centrech Fe/S (viz str. 144) nebo jsou součástí hemu (viz str. 108, 194, 310) a atom železa může být v různých oxidačních stavech od +4 až +2. Dalšími kovy zapojenými do redoxních reakcí mohou být měď (ve formě Cu 2+ / Cu +, viz str. 144), mangan (viz str. 132) a molybden (viz str. 186, 189).
Z organických látek se na redoxních reakcích často podílejí thioalkoholy (thioly) a odpovídající disulfidy (viz str. 18). Do této skupiny patří např. redoxní pár cystein/cystin (viz str. 192), lipoamid (viz str. 136) a glutathion (viz str. 278).
Pár chinon/hydrochinon je integrován do elektronového transportního řetězce (koenzym Q, viz str. 142), slouží jako koenzym (vitamin K, viz str. 352) nebo funguje jako antioxidant, chrání buňky před působením oxidantů (viz. str. 278).
Organické redoxní páry také zahrnují koenzymy obsahující pyridinový nukleotid a flavin (viz str. 86, 102 a 108).
















