Общее внешнее обследование При осмотре кожи ящерицы необходимо обратить внимание на наличие не только эктопаразитов, но и остатков старой кожи. Часто у игуан находят небольшие узелки под кожей. Кончик хвоста и кончики когтей не должны быть ни потемневшими, ни отмершими. У здоровых животных клоака снаружи чистая, без налипаний; полость рта без отложений и воспалительных изменений; нос чистый, без выделений или засохших остатков слизи. Глаза ясные. К общему обследованию относится также наблюдение за движением и бегом животного. Часто обнаруживают некоординированные движения или паралич одной из конечностей. Krevní test Для забора крови используются различные методы. Исследования крови являются дорогостоящими и предназначены скорее для целенаправленных исследовательских проектов, чем для рутинной работы. Взятие крови из Vena coccygealis ventralis Для этого находят место для укола вентрально от тела хвостового позвонка, каудально от клоаки, в центральной трети хвоста. Иглу вводят с каудальной стороны в краниальном направлении под углом 45 — 60° к коже, стараясь не повредить чешуйки, до хвостового позвонка. После прикосновения к кости иглу сдвигают несколько назад и производят забор крови. Этот же метод можно использовать и для ящериц, потерявших хвост, однако этих животных перед взятием крови необходимо успокоить с помощью седативных средств. Пункция сердца Можно выполнить пункцию сердца, однако она должна проводиться под ультразвуковым контролем. Кроме того, необходимо иметь в виду возможность кровоизлияния в перикард, причем сразу распознать его невозможно. Взятие крови из пальцев При укорачивании когтей можно получить кровь в очень небольших количествах. Vyšetření trusu Паразитологическое исследование кала проводится одинаково для ящериц и для змей. До включения новоприбывшего животного в группу необходимо получить, по меньшей мере, 2 отрицательных результата при исследованиях кала на наличие паразитов. У насекомоядных ящериц иногда находят в кале паразитов сверчков, саранчи и личинок мучного хрущака (так называемых мучных червей). До настоящего времени неизвестно, вызывают ли какие-либо нарушения у ящериц паразиты поедаемых ими животных. rentgenové vyšetření Рентгеновские снимки имеют большое значение для исследования скелета ящериц, а также незаменимы при подозрении на задержку яиц в яйцеводе, конкременты мочевого пузыря и инородные тела. Также на рентгеновских снимках распознаются кристаллы уратов в гранулемах печени. Если проводят, например, при нарушениях функционирования пищеварительного тракта исследование кишечника на наличие инородных тел, рекомендуется ввести сульфат бария или гастрографин (Gastrografin). Часто только в этом случае удается распознать инородные тела из искусственных материалов. Endoskopie Исходным условием для проведения оптимальной эндоскопии (целиоскопии) является воздержание от приема пищи в течение определенного промежутка времени. Для плотоядных ящериц (например, варанов) достаточно 3 — 7 дней, для растительноядных (например, больших сцинков) необходимы 2 — 4 недели голодания. Иммобилизация проводится с использованием кетам ина в дозах 50 — 100 мг/кг или изофлурана, вначале с помощью маски, а затем путем интубации. Для спокойных животных достаточно локальной анестезии 0,2 —0,3 мл лидокаина (Xylocain). Лежащей в боковом положении ящерице в начале последней трети тела, чаще всего между ребрами, делают разрез кожи и разделяют мышечную ткань. Для исследования используют эндоскоп диаметром 3 мм с углом обзора 30°. Кроме того, рекомендуют в полость тела инсуффлировать С02 под давлением 10 мм рт. ст. После исследования проводится закрытие кожи П-образным швом; для ящериц с большой чешуей, например короткохвостых сцинков, достаточно заклеивания с помощью Leukosilk. Эндоскопия является хорошим методом для определения пола ящерицы. Семенники имеют овоидальную форму, гладкую поверхность и желтый, белый или серый цвет. Семенники имеют форму бобов или треугольника с неровной поверхностью и могут содержать фолликулы различной величины. Яичники чаще всего желтые, фолликулы — цвета янтаря. Так как у рептилий отсутствует диафрагма, с помощью эндоскопии удается исследовать все внутренние органы, в том числе сердце. Ящерицы могут дышать при открытой брюшной полости. Поэтому искусственное дыхание при оперативном вмешательстве в брюшной и грудной полости не требуется. Ultrazvuková diagnostika Ультразвуковая диагностика является хорошим методом для оценки функционального состояния сердца, яичников, изменений внутренних органов и установления беременности. Для исследования ящериц рекомендуется частота 7,5 МГц. При исследовании кровеносной системы удается наблюдать движения сердца и сердечных клапанов. Можно подсчитать количество сокращений сердца. Также с помощью УЗИ возможна локализация места укола для проведения пункции сердца. В яичниках можно распознать фолликулы диаметром 2 мм, чего невозможно достигнуть с помощью рентгеновских снимков. С помощью УЗИ удается распознать смерть плода в яйцеводе у живородящих ящериц, непроходимость кишечника и копростаз. При подагре появляются отложения мочевой кислоты на перикарде, капсуле печени и в почечных канальцах в виде мелких сильно отражающих излучение точек. Poslech У ящериц возможно проведение аускультации сердца и легких. Для этого между фонендоскопом и чешуйчатой кожей животного помещают влажную вату или влажный кусочек ткани. Вследствие этого шумы трения о чешую сильно уменьшаются. Только у больших варанов можно различить сердечные тоны. Обычно удается распознать патологические изменения, прежде всего пневмонию. Электрокардиографическое исследование Для оценки заболеваний сердца ЭКГ до настоящего времени не использовалась, так как отсутствовали соответствующие значения для сравнения. Условием исследований является успокоение животного с помощью седативных средств. На результаты измерений сильное влияние оказывает температура тела животного.

- Katalog plemen
- Morfologie a anatomie
- Krmení psa
- Péče a výchova
- Výcvik psa
- veterinářství
- Psí porodnictví a gynekologie
- Štěně v domě
- Chov štěněte
- Zákony
- Lovci
- Zajímavá fakta
- Pár slov o psovi
- Katalog přezdívek
- Morfologie a anatomie
- Péče a výchova
- Krmení koček
- veterinářství
- Tajemství kočičího jazyka
- Katalog plemen
- Kotě v domě
- Katalog přezdívek
- Zajímavá fakta
- Obecné informace o koních
- Plemena koní
- pony plemena
- Chov a krmení poníků
- Zdraví vašeho poníka
- Jízda na ponících
- Morfologie a anatomie
- péče
- Krmení
- veterinářství
- Druhy okrasných ptáků
- Chov a chov ptactva
- Morfologie a anatomie
- péče
- Uspořádání akvária
- veterinářství
- Druhy akvarijních ryb
- Praktické rady
- Všeobecné veterinární lékařství
- Zacházení se zvířaty
- Nemoci psů
- Příznaky onemocnění psů
- Nemoci koček
- Nemoci trávicího ústrojí psů a koček
- Kardiorespirační onemocnění psů a koček
- Nemoci vnitřních ptáků
- Choroby ryb
- První pomoc
- Veterinární kliniky
- Lékárny
- Váš mazlíček je psychický
- Člověk a zvířata
- DIY módní oblečení pro kočky a psy
- Zoohoroskop
- Zajímavá fakta o zvířatech
02.04.2022/04.04.2022/2022-XNUMX/XNUMX/XNUMX Perm Cat BOOM! XNUMX – výstava koček
02.02.22-06.02.2022 Mezinárodní výstava psů Perm. permský. Zima 2022
14.08.2021-15.08.2021 Výstava Vladimíra “2xCACIB FCI”

Ještě jedna fotka
Autoři): LOS ANGELES. Stoyanov, doktor veterinární medicíny, vedoucí oddělení veterinární medicíny exotických zvířat Mezinárodní asociace oceanárií a delfinárií
Organizace: Síť oceanárií “Nemo”, Oděsa
Časopis: č. 2 – 2013
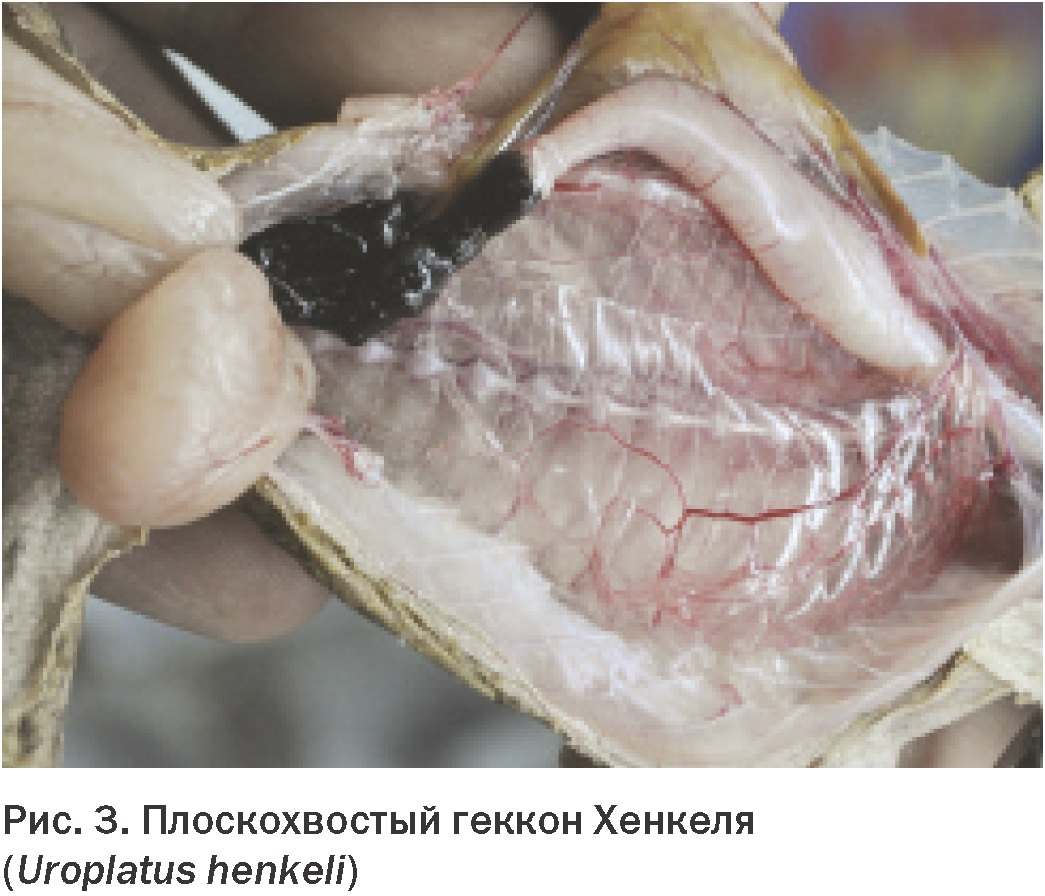
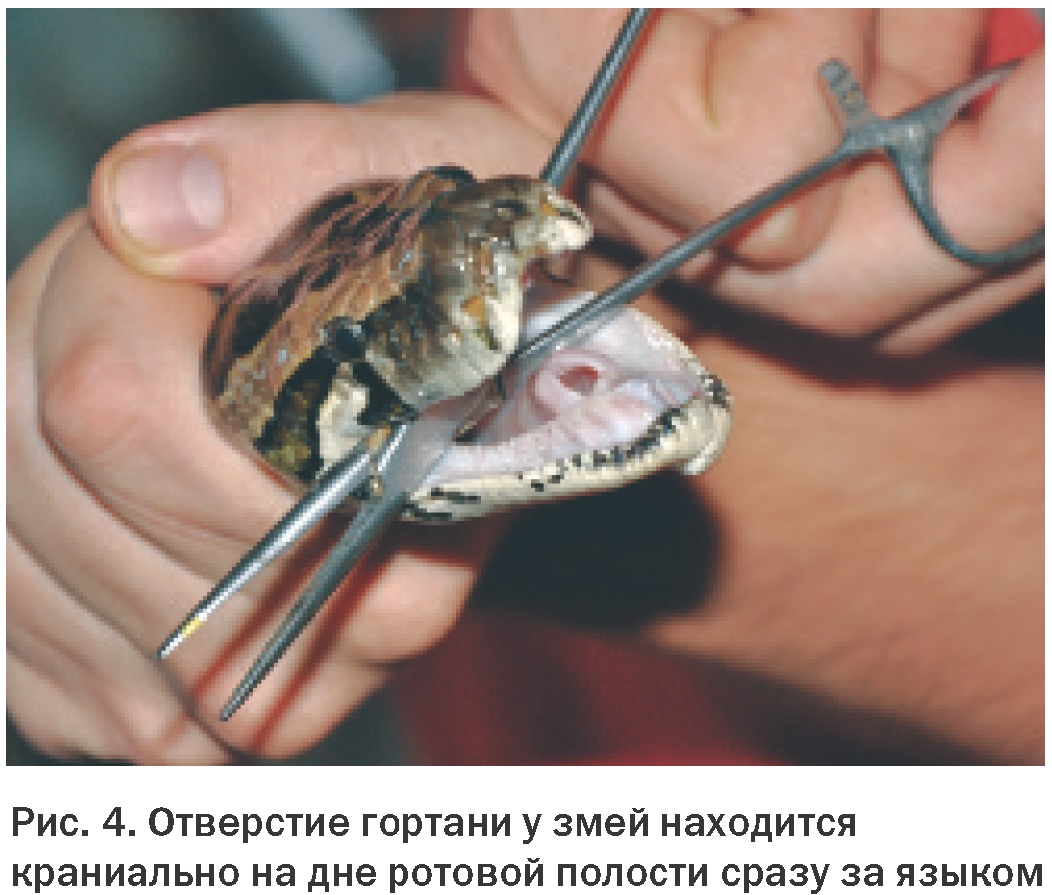
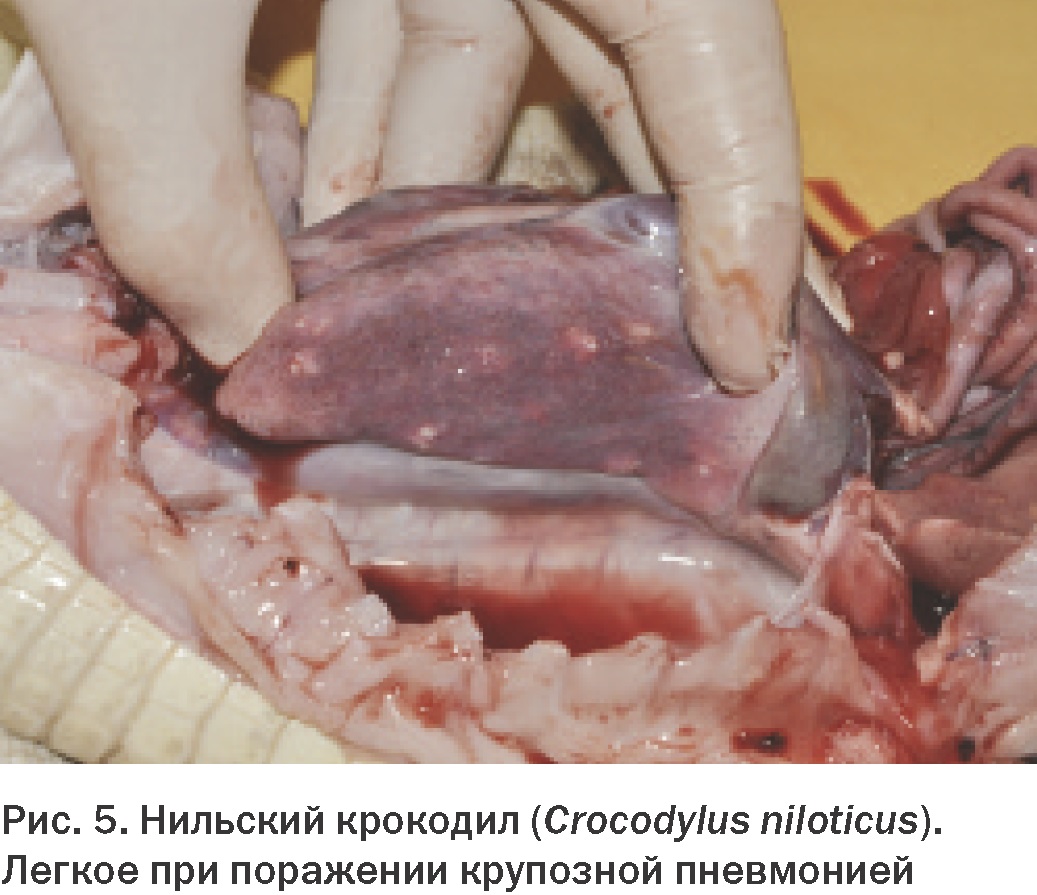
Konec. Začátek v čísle 1 pro rok 2013 Děkujeme redakci časopisu „World of Veterinary Medicine“, Ukrajina za laskavé poskytnutí článku L.A. Stoyanová Anatomie a fyziologie dýchacího systému Znalost normální anatomie a fyziologie dýchacího systému plazů je pro lékařskou praxi nesmírně důležitá. Přestože obecná struktura a funkce plic je obecně u různých řádů plazů stejná, byly mezi jednotlivými skupinami nalezeny některé klinicky významné rozdíly. Nedostatek pochopení anatomie a fyziologie dýchacího systému plazů zabrání účinné léčbě nemocí, jako je zápal plic, a nepříznivě ovlivní schopnost manipulovat s plazem v narkóze. Anatomie dýchacích cest Dýchací systémy plazů a savců jsou anatomicky a fyziologicky velmi odlišné. Významné rozdíly jsou také pozorovány mezi různými řády plazů a mezi druhy v rámci stejného řádu, zejména při srovnání vodních a suchozemských druhů. Níže jsou uvedeny hlavní klinicky významné znaky anatomie dýchacího systému želv, ještěrek, krokodýlů a hadů. Želvy Hrtan se u želv otevírá na bázi silného svalnatého jazyka v relativně kaudální části orofaryngu (Obr. 1). Toto uspořádání znesnadňuje přístup do dolních cest dýchacích přes dutinu ústní bez použití anestezie. Průdušnice s kompletními chrupavčitými prstenci se těsně pod krkem rozdvojuje. Dále párové průdušky v tvrdé skořápce vstupují do plic z dorzální strany. Plíce želv jsou párové a vakovitého tvaru. Struktury, ve kterých dochází k výměně plynů, nazývané alveoly, na rozdíl od alveolů savců, ústí na koncích průdušek do vzduchové dutiny plic. Bližší pohled na strukturu plic odhalí vnitřní výběžky a přepážky, které v průřezu připomínají houbu. Velký význam má obecná anatomie dolních dýchacích cest želv. Zánětlivý exsudát, zejména ten, který se tvoří při infekčních onemocněních, má tendenci se hromadit v dolní části plic, což brání jeho uvolňování přes průdušky a průdušnici, jak je tomu u savců. U želv je průchod plynů přes dýchací povrch pro výměnu plynů dosažen různými způsoby. Tyto rozdíly závisí na druhu a na tom, zda je vodní nebo suchozemský. Nádech i výdech jsou zpravidla aktivní procesy. Je však třeba poznamenat, že u vodních druhů je výdech pasivnější, zatímco u některých suchozemských druhů je vdechování pasivnější. Přestože želvy nemají skutečnou bránici, mnohé z nich mají strukturu podobnou membráně, která částečně odděluje hrudní a břišní dutinu, tzv. septum horizontale. U mořských želv toto rozdělení chybí. Vodní želvy obvykle používají během svého dýchacího cyklu čtyři svalové skupiny. Kontrakce bráničních a příčných břišních svalů stlačuje coelomickou dutinu, což má za následek výdech. Korakoidní a šikmé břišní svaly rozšiřují dutinu a poskytují inspiraci. Zajímavé je, že opakované pohyby hrdla, které majitelé domácích zvířat často mylně považují za dýchání, ve skutečnosti s dýcháním nesouvisí a mají čichovou funkci. V zemi středomořské želvy (Testudo graeca) byly zjištěny významné rozdíly. U tohoto druhu zajišťují dýchací pohyby svaly ramenního pletence. K nádechu dochází při kontrakci pilovitých a šikmých břišních svalů a k výdechu při kontrakci příčných břišních svalů a prsních svalů. Ještěrky U ještěrek není umístění otvoru hrtanu v dutině ústní stejné (Obr. 2). U mnoha druhů, zejména masožravců, se nachází v rostrální části úst. U jiných se nachází více ventrálně, u kořene masitého jazyka. U ještěrek, stejně jako u hadů, jsou tracheální prstence neúplné. Na rozdíl od želv se jejich průdušnice v krční oblasti nerozdvojuje, ale zůstává pevná, dokud nevstoupí do hrudní dutiny blízko srdce. Pod průdušnicí se dělí na levou a pravou průdušku. Plíce ještěrek jsou přibližně stejné velikosti a objemu a jejich stavba je stejná jako u ostatních plazů (obr. 3). U mnoha ještěrek dochází k výměně plynů v kraniální části plic. Kaudální expanze plic je podobná vzdušnému vaku u ptáků. Tato vlastnost je důležitá, protože produkty zánětlivých procesů se mohou hromadit v této nerespirační části plic. Vzhledem ke špatné vaskularizaci této oblasti zde mohou infekce přetrvávat a nereagovat na parenterální medikaci. Stejně jako u želv je nádech a výdech u ještěrek aktivními procesy. U většiny druhů se provádějí pomocí mezižeberních svalů. Některé druhy také používají hladkou svalovinu uvnitř plic k nádechu. U většiny druhů po nádechu a výdechu bezprostředně následuje období zadržování dechu, které se liší délkou trvání. Někteří ještěři, například varani, mají membránu, která odděluje srdce a plíce od zbytku vnitřních orgánů, podobně jako bránice mezi hrudní a břišní dutinou savců. Tato membrána nemá žádnou dýchací funkci. Hadi Otvor hrtanu je u hadů umístěn blíže k nosu v dutině ústní a umožňuje tak dýchání při polykání potravy (Obr. 4). Umožňuje také přímou kontrolu a tracheální intubaci u většiny hadů bez použití anestezie. Průdušnice s neúplnými C-kroužky vstupuje do plic na úrovni spodní části srdce. Některé druhy mají „tracheální plíce“ umístěné na hřbetní straně průdušnice. Tato struktura slouží k pokračování výměny plynů v případě stlačení plic spolknutou kořistí. U většiny hadů je levá plíce zakrnělá nebo chybí. Nejprimitivnější druhy, jako jsou hroznýši, mají plíce obě, ale levá je menší. Plíce většiny hadů mají dvě části. První třetina nebo polovina plic funguje normálně, ale zadní část je poměrně řídce prostoupena krevními cévami a je podobná vzdušnému vaku u ptáků. Kraniální nebo respirační část plic obvykle začíná na 20 % a končí na 40 % celkové délky od nosu po kloaku. Kaudální neboli membranózní část plic se nachází dále a má u různých druhů různou délku. Dýchací cyklus hadů zahrnuje aktivní a pasivní fáze. Výdech je řízen dorzolaterálními (transversus dorsi a superior internal costalis) a ventrolaterálními (transversus abdominis a šikmý) svalovými vrstvami. Uvolnění svalů, které umožňují výdech, je první pasivní fází nádechu. Aktivní součástí nádechu je zvednutí žeber v důsledku kontrakce žeber zvedače a žeber retraktoru. Poslední fáze dechového cyklu, pasivní výdech, nastává v důsledku relaxace inspiračních svalů a kolapsu plic. Krokodýli Hrtan se u krokodýlů otevírá kaudálně za dobře definovanou supraglotickou chlopní. Spolu s hyoidní kostí dokáže uzavřít dutinu ústní a umožnit tak zvířeti dýchat při částečném ponoření i s otevřenou tlamou. Dutina jejich vnitřních orgánů je rozdělena na dvě části svalovou přepážkou, podobnou bránici. K ní přiléhá kraniální část jater. Kaudálně jsou játra spojena s pánevním pletencem párem bráničních svalů. Kontrakce těchto svalů spolu s mezižeberními svaly je také zaměřena na inspiraci a často se nazývá „jaterní píst“. Aktivní výdech je vytvářen v důsledku stlačení tělesné dutiny příčnými svaly. Plíce krokodýlů jsou složitější než plíce jiných plazů. Parabronchi je rozdělují na řadu samostatných komor (Obr. 5). Přes obrovské rozdíly v obecné anatomii dýchacího systému plazů je jeho mikroskopická struktura zcela jednotná. Trachea je vystlána víceřadým řasinkovým, sloupcovým epitelem s různým počtem pohárkových buněk. Na konci velkých dýchacích cest velkého průměru řasinkový epitel mizí a je nahrazen epitelem dlaždicovým. Retikulární alveolární plíce se skládá z tenkostěnných kapilár procházejících mezi epiteliálními stěnami alveolů. Kaudální plíce, bez krevních cév, je vystlána jednoduchým dlaždicovým epitelem. Fyziologie dýchání Když už mluvíme o fyziologii dýchání, měli bychom zvážit tři složky respiračního mechanismu: za prvé, pohyb dýchacích plynů z vnějšího prostředí na povrch výměny plynů, za druhé, pohyb kyslíku a oxidu uhličitého přes dýchací epitel a za třetí cirkulace krve přenášející kyslík a oxid uhličitý z plic do tkání a následná difúze plynů na buněčné úrovni. Jak bylo ukázáno dříve, plazi mají jedinečné systémy pro asimilaci a odstraňování dýchacích plynů. Ačkoli se způsob fungování těchto systémů u druhů plazů značně liší, všechny ostatní dýchací procesy jsou obecně stejné. Klinický význam má schopnost plazů anaerobně metabolizovat. Speciální pufrovací systémy přítomné v oběhovém systému umožňují kontrolovat akumulaci kyseliny mléčné a vodíkových iontů během období anaerobiózy. Díky této schopnosti mohou i závažná onemocnění dýchacího systému zůstat skryta, dokud jejich progrese nepřekročí kompenzační vlastnosti organismu. Výměna plynů u plazů není omezena na plicní alveoly. Mnoho vodních druhů je schopno výměny plynů prostřednictvím své kůže. Želvy, jako je softshellová želva (Apalone spp.), mohou během ponoru přijmout až 70 % kyslíku přes jejich kožovitý plášť. Bukálně-hltanové membrány jsou také povrchy pro výměnu plynů u mnoha plazů a faryngeální papily, hustě prostoupené krevními cévami, jsou schopny extrahovat kyslík rozpuštěný ve vodě. Želvy s měkkým krunýřem mohou získat dostatek kyslíku kůží a orofaryngem během dlouhých ponorů, například během hibernace. Mnoho druhů ještěrek je také schopno určitého stupně faryngeálního a kožního dýchání. Jak již bylo zmíněno dříve, některé druhy hadů se vyznačují zvláštním váčkovitým výběžkem otevřených prstenců průdušnice, který slouží k výměně plynů v případě, že obsah žaludku narušuje normální fungování plic. Dýchání poikilotermních živočichů je řízeno parciálním tlakem kyslíku, oxidu uhličitého a teplotou. S rostoucí teplotou roste i potřeba kyslíku. Obvykle se kompenzuje nikoli zvýšeným dýcháním, ale zvýšením dechového objemu. Navíc hyperkapnie (zvýšené hladiny CO2) také způsobuje zvýšení dechového objemu, zatímco hypoxie vede ke zvýšenému dýchání. Podnětem pro rychlé dýchání u plazů je nízká koncentrace kyslíku v krvi. Při významné plicní patologii je schopnost pacienta zvyšovat dechový objem narušena v důsledku zánětlivých procesů, buněčné infiltrace a ztráty elasticity tkání. Je klinicky důležité, aby podmínky s vysokými hladinami kyslíku ve vzduchu vedly k potlačení vlastních dýchacích pohybů u plazů. Přestože nepřítomnost bránice a slabý bronchociliární transport zhoršuje vylučování zánětlivého exsudátu z plic, dlouhodobé vystavení prostředí bohatému na kyslík tomu bude dále bránit v důsledku potlačení ventilace. Proto by se použití kyslíkových komor mělo používat pouze v případech podezření na hypoxémii. Relativní nevýkonnost plic v kombinaci se schopností plazů přejít na anaerobní metabolismus hraje důležitou roli v patologiích dýchacího systému. Závažná onemocnění dýchacích cest mohou způsobit zvýšený odpor v plicních cévách. Vzhledem k tomu, že tyto změny jsou podobné těm během zadržení dechu nebo ponoření, vedou ke změnám ve fungování srdce. Při normálním dýchání srdce plazů, kromě krokodýlů, posílá do plicní tepny nejvíce krve chudé na kyslík. Zvýšení odporu plicních cév vede k odklonu krve z plic do systémového oběhu. Pokud dojde k odklonu v důsledku patologie, může být transport kyslíku do periferních tkání obtížný. Při déletrvající anaerobióze v důsledku přetížení krevního pufrovacího systému vzniká acidóza, která je život ohrožující. ■ Literatura 1. Jackson CG Jr: Kardiovaskulární systém. V Harless M, Morlock H, editoři: Turtles: perspectives and research, Melbourne, Fla, 1979, Krieger Publishing. 2. Bílá FN: Cirkulace. V Gans C, editor: Biology of the reptilia, sv 5, New York, 1976, Academic Press. 3. Williams DL: Kardiovaskulární systém. V Beynon PH, Lawton MPC, Cooper JE, editoři: Manuál plazů, Cheltenham, Spojené království, 1992, British Small Animal Veterinary Association. 4. Smith JA, McGuire NC, Mitchell MA: Kardiopulmonální fyziologie a anestezie u krokodýlů, Proc Assoc Reptil Amphib Vet 17-21, 1998. 5. Holz PH: The plazí ledvinový portálový systém – přehled, Bull Assn Reptil Amphib Vet (Amphib Vet) 9): 1-4, 9. 1999. Davies PMC: Anatomie a fyziologie. V Cooper JE, Jackson OF, editoři: Diseases of the Reptilia, sv. 6, New York, 1, Academic Press. 1981. Anderson JB, Rourke BC, Caiozzo VJ, Bennett AF, Hicks JW: Postprandiální srdeční hypertrofie u krajt, Nature (7): 434–37, 38. 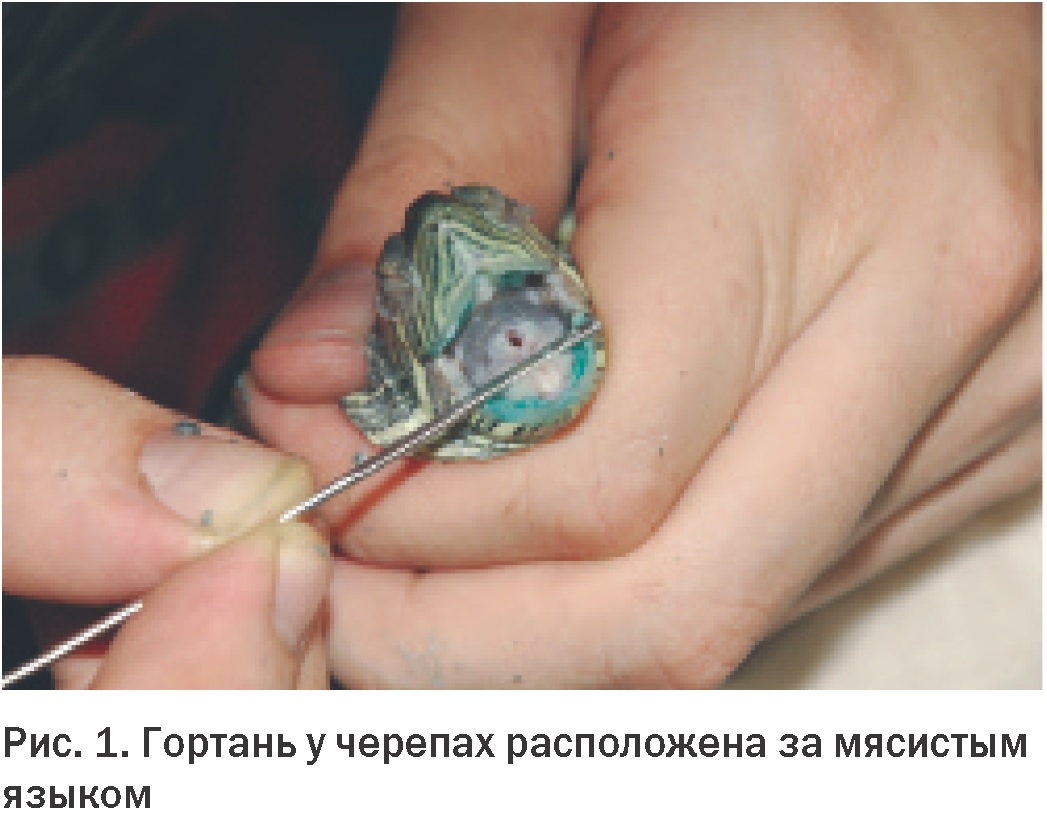


č. 4–2021 časopis VetPharma

č. 3–2021 časopis VetPharma

č. 2-2021 časopis VetPharma

№1 – 2021 časopis VetPharma

№1 – 2020 časopis VetPharma

№3 – 2019 časopis VetPharma















