Písmena pH najdeme na kelímku krému na obličej, ve výsledcích lékařských testů, ve zprávě ekologa nebo průmyslového inženýra. Pojďme zjistit, co je tento všudypřítomný ukazatel, jak jej vypočítat a použít.
· Aktualizováno 25. října 2022
Co je pH a proč je potřeba?
Vodné roztoky látek mohou být kyselé, neutrální nebo zásadité. Kyselost prostředí závisí na vzájemné koncentraci kladně nabitých vodíkových iontů (H + ) a záporně nabitých hydroxidových iontů (OH − ).
Je-li v roztoku [H + ] > [OH − ], pak se nazývá kyselý,
pokud [OH − ] > [H + ] — zásadité,
pokud [H + ] = [OH − ] — neutrální.
V neutrálním roztoku je koncentrace H + a OH − zanedbatelná, protože tyto ionty spolu aktivně interagují za vzniku nízkodisociační sloučeniny H2A. Proto jsou v neutrálním roztoku přítomny pouze ty vodíkové ionty a hydroxidové ionty, které vznikly jako výsledek reverzibilní disociace:
Disociační konstanta je nevýznamná a rovná se:
Koncentrace vody se v roztoku prakticky nemění, takže výraz pro disociační konstantu vody můžeme zjednodušit:
Výsledný výraz se nazývá iontový produkt vody. Tato hodnota je při dané teplotě konstantní (pro T = 22–25 °C Kw = 10 −14 ) pro vodu a její roztoky.
Koncentrace iontů H + a OH − při pokojové teplotě je vždy stejná a rovná se:
[H+] = [OH -] = 10 -7 mol/l.
Pro charakterizaci kyselosti média je vhodnější použít hodnota PH (čti „peash“), což se rovná dekadickému logaritmu hodnoty [H+] se záporným znaménkem. Vzorec pro výpočet pH:
Název veličiny naznačuje, že kyselost nebo zásaditost média lze vyjádřit pouze koncentrací vodíkových iontů.

Výpočet hodnoty pH pro roztoky různé kyselosti
Zkusme vypočítat pH pro čistou vodu a neutrální vodné roztoky:
pH= −log[H+] = −log10 −7 = −(−7) = 7.
Pro neutrální vodné roztoky a čistou vodu je pH = 7.
Vypočítejme hodnotu pH pro roztok silné jednosytné kyseliny (například HCl) o koncentraci 1 mol/l. Koncentrace vodíkových iontů H + je rovněž 1 mol/l. Dosadíme hodnoty do iontového součinu vody, který si v tomto řešení zachová hodnotu 10 −14:
Кw = [H + ][OH − ] = [1 mol/l] × [OH − ] = 10 −14.
V tomto případě [H+] = 10 (protože 0 = 10 mol/l).
Potom pH = −log10 0 = 0.
Pro roztoky silných kyselin pH = 0.
Vypočítejme hodnotu pH pro roztok silné zásady (například KOH) o koncentraci 1 mol/l. Iontový produkt vody má formu:
Proto pH = −log10 −14 = 14.
Pro roztoky silných zásad je pH = 14.
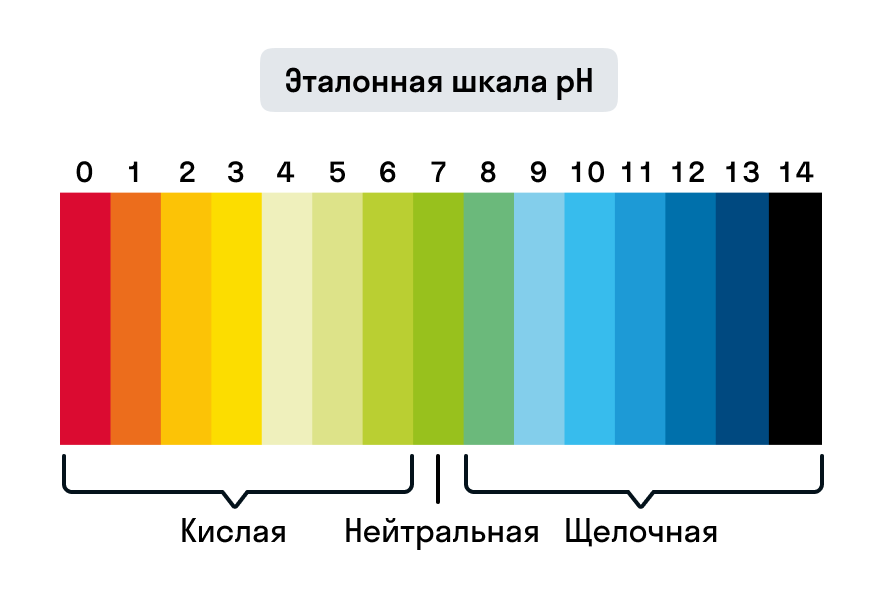
Hodnoty pH se tedy mohou pohybovat od 0 do 14. Čím nižší pH, tím kyselejší prostředí. A naopak: čím vyšší pH, tím vyšší zásaditost prostředí.
Silně kyselé vlastnosti roztoku jsou charakteristické pro pH = 0–3, silně zásadité vlastnosti pro pH = 12–14.
Hodnoty pH v závislosti na povaze média:
- v neutrálních vodných roztocích pH = 7;
- v kyselých kyselinách – pH < 7;
- v alkalickém prostředí – pH > 7.

Vodíkový indikátor v každodenním životě a výrobě
V běžném životě je za neutrální prostředí považováno rozmezí pH = 5–8,5. Roztoky takové kyselosti (nebo zásaditosti) jsou bezpečné pro lidskou pokožku a sliznice. Níže jsou uvedeny hodnoty pH některých látek, se kterými se setkáváme v každodenním životě:

Hodnota pH je důležitá v mnoha průmyslových odvětvích:
- v kosmetologii je mnoho produktů testováno na optimální hodnotu pH pro bezpečnost pokožky;
- v zemědělství se pro pěstování plodin určuje kyselost prostředí;
- v ekologii změny kyselosti dešťové vody, řek, jezer ukazují na zhoršení podmínek prostředí atd.
Teorii si snáze zapamatujete, pokud je podložená příklady z reálného života. Studenti online kurzů chemie na Skysmart se v každé lekci dozvídají něco nového o světě kolem sebe a učí se aplikovat znalosti v praxi.

Metody stanovení hodnoty pH roztoku
Povaha média (kyselé, neutrální nebo zásadité) se určuje pomocí indikátoru.
Ukazatele – látky, které mění barvu roztoku při různých hodnotách pH.
K určení povahy média stačí přidat několik kapek vodně-alkoholového roztoku indikátoru do studovaného roztoku – a barva se změní.
V praxi jsou nejčastějšími indikátory methyloranž, lakmus a fenolftalein. Barva těchto indikátorů v kyselém, neutrálním a zásaditém prostředí je uvedena v tabulce:
Stanovení pH média pomocí indikátoru je rychlá a vizuální metoda, ale pro stanovení přesnější hodnoty pH se používá univerzální indikátor.
Univerzální indikátor je směs sušených látek nanášená na papír. S jeho pomocí můžete určit povahu prostředí v širokém rozmezí pH – od 1 do 14.
Pro měření hodnoty pH se testovací roztok nanese na papírový proužek a poté se barva indikátoru porovná se standardní stupnicí.
Kromě určení povahy média můžete pomocí indikátoru sledovat změny koncentrace složky v roztoku. Například neutralizační reakce (reakce mezi kyselinou a zásadou) probíhá bez jakýchkoliv známek (srážení nebo vývin plynu). Pokud ale do kyselého roztoku přidáte lakmusový indikátor, roztok zčervená a po přidání zásady zfialoví. Změna barvy indikátoru potvrdí průběh neutralizační reakce.
Pomocí speciálního zařízení pH metr umožňuje měřit hodnoty pH v širším rozsahu a s větší přesností (až 0,01 jednotek pH) ve srovnání s indikátory.
Činnost pH metru je založena na měření elektromotorické síly (EMF), kterou vytvářejí elektrody po ponoření do roztoku.

Samotestovací otázky
- Jaké hodnoty pH jsou typické pro kyselé, neutrální a zásadité prostředí?
- V jakých oblastech vědy a výroby je nutné měřit hodnoty pH roztoku látky? Uveďte několik příkladů.
- Co je indikátor? Jak jej můžeme použít k určení povahy prostředí?
- Jaké jsou výhody univerzálního indikátoru?
- Jak se jmenuje přístroj pro přesnější stanovení pH prostředí? Dejte jeho přednosti.
Spoluautoři: Chris Hasegawa, PhD. Dr. Chris Hasegawa je bývalý vědecký instruktor a děkan na California State University, Monterey Bay. Specializuje se na výuku studentů komplexních vědeckých konceptů. Má bakalářský titul v oboru biochemie, magisterský titul v oboru vzdělávání a vyučující certifikát z University of California, Davis. Získal doktorát v oboru plánování a výuky na University of Oregon. Než se stal členem fakulty, prováděl biochemický výzkum v neurofarmakologii na National Institutes of Health. Učil také fyziku a biologii a pracoval jako správce veřejné školy v Kalifornii, Oregonu a Arizoně.
Počet zobrazení tohoto článku: 142 254.
V běžném životě pH obvykle znamená stupnici používanou k popisu neutrality nebo naopak nedostatku neutrality látky. Z vědeckého hlediska hodnota pH odpovídá počtu iontů v chemickém roztoku. Pokud studujete chemii nebo příbuzné předměty, možná budete muset vypočítat hladinu pH na základě koncentrace látek v roztoku. Hodnota pH se zjistí pomocí následujícího vzorce: pH = -lg[H3O+].
Co je pH

- Seznamte se se stupnicí pH. Hodnoty na stupnici pH se pohybují od 1 do 14. Čím nižší číslo, tím kyselejší je roztok. Naopak, čím vyšší hodnota, tím zásaditější je roztok. [2] Zdroj informací X Například pH pomerančové šťávy je 2, protože šťáva je poměrně kyselá kapalina. Chlorové bělidlo má pH 12, protože je vysoce alkalické. [3] X Zdroj informací Uprostřed stupnice jsou relativně neutrální roztoky, např. voda, která má pH 7.
- Rozdíl 1 bodu na stupnici pH mezi dvěma roztoky znamená, že se 10krát liší v kyselosti. Pokud například vezmete dva roztoky s hodnotami pH 6 a 7, kyselost prvního roztoku s pH 6 bude 7krát vyšší než kyselost druhého roztoku s pH 10. A například kyselost roztoku s pH 6 je 8krát vyšší než kyselost roztoku s pH 100. [4] X Zdroj informací

- Někdy se vzorec zapisuje jako pH = -lg[H + ]. Nezáleží na tom, zda je H v rovnici3O + nebo H +, obě formy psaní jsou ekvivalentní.
- Pro zjištění pH není nutné umět vypočítat dekadický logaritmus, protože téměř každý vědecký nebo technický kalkulátor má možnost jej vypočítat.

Seznamte se s pojmem koncentrace. Koncentrace látky odpovídá počtu částic této látky přítomných v roztoku. [6] X Zdroj informací Koncentrace se zpravidla vyjadřuje v počtu molů na jednotku objemu a označuje se m/V nebo M. V chemických laboratořích se koncentrace roztoků píší na lahvičky s nimi. Pokud řešíte chemický problém, může být koncentrace uvedena ve stavu, nebo ji potřebujete najít.
Výpočet pH ze známé koncentrace

- V chemii hranaté závorky označují koncentraci něčeho. Vzorec pro výpočet pH tedy zní „pH se rovná zápornému logaritmu koncentrace hydroniových iontů“.

- Pokud je například koncentrace 1,05 x 10 5 M, napište vzorec pro výpočet pH takto: pH = -log[1,05 x 10 5 M]

Vypočítejte pH. K tomu je vhodné použít vědeckou kalkulačku. Nejprve zadejte znaménko mínus stisknutím tlačítka „+/-“. Poté klikněte na tlačítko “log” odpovídající dekadickému logaritmu (desetinný logaritmus se v angličtině zapisuje jako log). Na obrazovce se zobrazí „-log“. [9] X Information Source Poté stiskněte levou závorku a zadejte koncentraci. V případě potřeby nezapomeňte zadat hodnotu stupně. [10] X Zdroj informací Poté uzavřete závorky. [11] X Zdroj informací Výsledkem je, že na obrazovce kalkulačky uvidíte „-log(1,05 × 10 5 ). Klikněte na ” image” data-data-src=”https://www.wikihow.com/images_en/thumb/d/d6/Calculate-pH-Step-7.jpg/v4-460px-Calculate-pH-Step-7.jpg” alt=”Step 1 Определите, что дано и что требуется найти.” width=”460″ height=”345″>
Určete, co je dáno a co je třeba najít. Zapište si vzorec pro výpočet pH. Poté zjistěte známá množství zapsáním jejich hodnot pod vzorec. Pokud například víte, že pH je 10,1, napište toto číslo pod hodnotu pH ve vzorci.

- Transformace rovnosti pH = -log[H3O + ], získáme vzorec +[H3O + ] = 10 -pH, to znamená, že koncentrace iontů je rovna deseti mocnině -pH. Nyní místo pH dosadíme známou hodnotu, v našem případě 10,1.

- V našem příkladu je pH 10,1. Zadejte „10“ a stiskněte klávesu „EXP“. Poté stiskněte „-/+“ a změňte znaménko. Nakonec zadejte hodnotu pH „10,1“ a stiskněte tlačítko „=“. Výsledek by měl být 1e-100. To znamená, že koncentrace je 1,00 x 10-100 M.

Zvažte odpověď, kterou dostanete. Má to fyzický význam? Pokud je pH 10,1, znamená to, že koncentrace hydronia je extrémně nízká a máte alkalický roztok. [12] X Zdroj informací Zjištěná velmi nízká koncentrace tedy odpovídá
- Pokud se vám zpočátku zdá, že výpočet úrovně pH je obtížný, nezapomeňte, že existuje mnoho zdrojů, kde se můžete o tomto tématu dozvědět více. Použijte učebnici chemie nebo požádejte svého učitele, aby vám pomohl.
Další články

zjistit počet protonů, neutronů a elektronů

napsat iontovou rovnici

napište elektronovou konfiguraci atomu libovolného prvku

vyrobit sloní zubní pastu
vytvořit krystaly soli

vypočítat koncentraci roztoku

vypočítat normalitu řešení

zjistit počet neutronů v atomu

bilanční chemické rovnice

použijte periodickou tabulku

identifikovat valenční elektrony

najít entalpii reakce


- ↑http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
- ↑http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
- ↑http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
- ↑http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
- ↑https://www.mathsisfun.com/algebra/logarithms.html
- ↑http://www.gcsescience.com/m28.htm
- ↑http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch17/ph.php
- ↑http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch17/ph.php
- ↑http://www.chemteam.info/AcidBase/pH.html
- ↑http://www.chemteam.info/AcidBase/Calculator-Warning.html
- ↑http://www.chemteam.info/AcidBase/pH.html
- ↑http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
O tomto článku
Učitel přírodních věd a děkan v důchodu
Spoluautoři: Chris Hasegawa, PhD. Dr. Chris Hasegawa je bývalý vědecký instruktor a děkan na California State University, Monterey Bay. Specializuje se na výuku studentů komplexních vědeckých konceptů. Má bakalářský titul v oboru biochemie, magisterský titul v oboru vzdělávání a vyučující certifikát z University of California, Davis. Získal doktorát v oboru plánování a výuky na University of Oregon. Než se stal členem fakulty, prováděl biochemický výzkum v neurofarmakologii na National Institutes of Health. Učil také fyziku a biologii a pracoval jako správce veřejné školy v Kalifornii, Oregonu a Arizoně. Tento článek měl 142 254 zobrazení.
















